Fórmula del ácido acético. Ácido acético Producción de ácido acético
Elija una respuesta correcta. 1. El ácido acético no puede reaccionar con:
1. El ácido acético no puede reaccionar con:
1) sulfato de potasio 3) amoníaco
2) glicerina 4) cloruro de fósforo (V)
2. El ácido fórmico se puede distinguir de otros ácidos usando:
1) solución de cloruro de hierro (III)
2) solución amoniacal de óxido de plata (I)
3) solución de tornasol
4) agua de bromo
3. Los ácidos carboxílicos limitantes dibásicos incluyen:
1) oxálico y valérico 3) propiónico y succínico
2) malónico y aceitoso 4) ámbar y adípico
4. Limitación de ácidos grasos superiores que contienen 16 átomos de carbono:
1) palmítico 3) esteárico
2) oleico 4) araquidónico
5. Los productos de la descarboxilación del ácido oxálico son:
1) ácido butírico 3) ácido acético
2) ácido propiónico 4) ácido fórmico
6. Una sustancia que puede reaccionar con ácido fórmico y
metanalema, tiene la fórmula:
1) NaOH 2) Cu(OH) 2 3) CH 4 4) HBr
7. Los ácidos carboxílicos limitantes son:
1) crotón y acético
2) propiónico y palmítico
3) linoleico y oleico
4) esteárico y araquidónico
8. Grupo funcional - COOH está presente en la molécula:
1) formaldehído 3) ácido acético
2) acetato de etilo 4) fenol
1) CH 2 Cl - COOH 3) CH 2 I - COOH
2) CH 2 Br - COOH 4) CH 3 - COOH
10. El ácido acético interactúa con:
1) hidróxido de sodio y cloruro de magnesio
2) cloro y agua
3) carbonato de sodio y magnesio
4) etanol y etanal
LÍPIDOS
Los lípidos son un grupo grande y heterogéneo de compuestos naturales unidos por una propiedad común: su insolubilidad práctica en agua y buena solubilidad en solventes orgánicos. Los lípidos, dependiendo de la capacidad de hidrolizarse, se dividen en saponificables e insaponificables.
Cera- ésteres de ácidos grasos superiores y alcoholes monohídricos superiores.
Éster cetílico del ácido palmítico (spermaceti)
Miricil éster de ácido palmítico (cera de abejas)
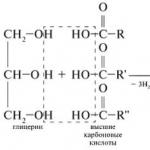
Grasas y aceites(grasas neutras) - ésteres de glicerol de ácidos grasos superiores. Triglicéridos con ácidos carboxílicos superiores saturados (VKK), sólidos - grasas; con VKK insaturado, líquido - aceites. Si los tres ácidos de la molécula son iguales, es un triglicérido simple; si son diferentes, es una mezcla.




Conservante de alimentos E260 - ácido acético. Es conocido por todas las personas que saben al menos un poco sobre el arte de la gastronomía.
Se forma como resultado de la acidificación natural de lo natural. Durante este período, ya comienza a fermentar. Además, el ácido acético está directamente involucrado en el proceso metabólico del cuerpo humano.
El conservante de alimentos tiene un olor fuerte. La especie pura actúa como un líquido incoloro que absorbe la humedad del ambiente.
Puede congelarse solo a una temperatura de -15 grados. Al congelarse se forman muchos cristales transparentes.
El vinagre es 3-6% de ácido acético. Una solución al 70-80% ya se llama esencia de vinagre. E260 se usa no solo en la producción industrial, sino también en la cocina casera de varios platos.
El vinagre es un representante del carbono con la capacidad de exhibir una alta función reactiva. Tan pronto como entra en reacción con otras sustancias, comienza a iniciar compuestos de derivados funcionales. Como resultado de tales reacciones, se forman sales, amidas y ésteres.
Debe disolverse en agua y al mismo tiempo no crear impurezas mecánicas, y además tener una proporción establecida de componentes de calidad.
¿Dónde se aplica?
Básicamente, el ácido acético se usa en la fabricación de varios conservantes y adobos.
Además, también se utiliza en la producción industrial de conservas vegetales y confitería.
A menudo, un conservante de alimentos se usa como desinfectante y desinfectante.
Sin embargo, el ácido acético se usa no solo en la preparación de varios alimentos, sino también en otras industrias.
E260 en la producción de alimentos
 Su ámbito de actividad depende de las propiedades del ácido acético. Su principal valor radica en su palatabilidad y carácter ácido.
Su ámbito de actividad depende de las propiedades del ácido acético. Su principal valor radica en su palatabilidad y carácter ácido.
El vinagre se divide en varios tipos, a saber: manzana, balsámico, cerveza, caña, dátil, miel, pasas, palma y muchos otros.
A menudo, el ácido se usa en la fabricación de adobos, que luego sirven como base para enlatar verduras.
Incluso la receta más famosa para marinar carne para barbacoa es agregar vinagre.
Tiene fuertes propiedades antibacterianas. Por lo tanto, todos los adobos se preparan sobre esta base. Gracias a esto, las verduras enlatadas se almacenan por más tiempo sin condiciones de cierta temperatura.
Dañar
El vinagre es una sustancia tóxica, por lo que el uso de grandes dosis y mal concentrado puede acarrear graves trastornos en el organismo humano. En términos simples, el grado de peligro depende de cuán correctamente lo críes.
La solución más peligrosa para los humanos, cuya concentración supera el 30%. Si dicha solución entra en contacto con la membrana mucosa y la piel, puede causar una quemadura química grave.
El uso de vinagre está permitido en la industria en todo el mundo, ya que es completamente seguro cuando se usa correctamente.
¿Dónde más se usa?
Se utiliza no solo en la producción de diversos productos alimenticios, sino también en:
- condiciones domésticas (elimina eficazmente las incrustaciones dentro de las teteras y cuida las superficies de trabajo);
- industrias químicas (actúa como solvente y reactivo químico);
- el campo médico (los medicamentos se fabrican sobre su base);
- otras áreas de la industria.
¿Cual es el uso?
 El ácido acético está involucrado en el proceso de dividir los carbohidratos y que ingresan al cuerpo humano con los alimentos.
El ácido acético está involucrado en el proceso de dividir los carbohidratos y que ingresan al cuerpo humano con los alimentos.
Tarifa diaria
Hasta la fecha, los expertos no han determinado cuál es la dosis diaria de este conservante alimentario. A pesar de que es muy popular en la cocina, los científicos no han calculado cuánto necesita o puede usar una persona dicha sustancia.
En la práctica médica, aún no ha habido casos en que una persona tenga una falta de una sustancia en el cuerpo, lo que conduce a trastornos graves. Pero al mismo tiempo, hay un cierto grupo de personas para las que este conservante está contraindicado. Los médicos no lo recomiendan a pacientes con inflamación de la mucosa gástrica, úlceras e inflamación del sistema digestivo.
Los expertos explican esto por el hecho de que el conservante puede irritar y destruir la mucosa gástrica. En el mejor de los casos, si el paciente experimenta solo acidez estomacal y, en el peor de los casos, una quemadura del sistema digestivo.
Además, hay otra razón por la que vale la pena abandonar tales sustancias: la intolerancia individual del cuerpo. Para evitar tales complicaciones, es mejor rechazar tales alimentos.
Sobredosis
El vinagre afecta a la salud humana de la misma forma que el ácido clorhídrico, sulfúrico o nítrico. La única diferencia con los ácidos anteriores es el efecto de superficie.
Después de experimentos científicos, los científicos llegaron a la conclusión de que una dosis letal para humanos es de 11 ml. Se trata de un vaso de vinagre de mesa o 30 ml de esencia.
Cuando los vapores de la sustancia ingresan a los pulmones, pueden provocar una inflamación grave de los tejidos pulmonares con consecuencias graves.
Otra consecuencia grave de una sobredosis es la muerte del tejido, la cirrosis complicada y la muerte de las células renales.
Cómo interactúa con otras sustancias
Se notó una excelente interacción con las proteínas, mientras que el cuerpo lo absorbe más fácilmente.
Una interacción similar con los carbohidratos. Ayuda al cuerpo a absorber más fácilmente la carne, el pescado y los alimentos vegetales.
Pero recuerde que esos momentos positivos solo son posibles con el buen funcionamiento del sistema digestivo.
A menudo, las personas usan esta sustancia como base para la preparación de medicamentos. Alivia eficazmente la inflamación y reduce la temperatura corporal.
El aditivo conservante con el número digital E260 ha sido aprobado oficialmente y se permite su uso en la producción de diversos alimentos en todo el mundo.
Después de realizar una gran cantidad de experimentos y estudios de laboratorio, los científicos llegaron a la conclusión de que el uso correcto y la dosis permitida no tienen un efecto negativo en el cuerpo humano.
El cuerpo absorbe completamente. Este es un tipo de metabolito intermedio (un producto del metabolismo de cualquier compuesto), que realiza funciones energéticas y estructurales en la mayoría de los procesos metabólicos. Para no dañar su salud, debe poder diluir correctamente E260 con agua. Una solución al 30% es un gran peligro para los humanos. Siga todas las reglas de uso.
El ácido etanoico es mejor conocido como ácido acético. Es un compuesto orgánico con la fórmula CH 3 COOH. Pertenece a la clase de ácidos carboxílicos, cuyas moléculas contienen grupos carboxilo monovalentes funcionales COOH (uno o varios). Puede proporcionar mucha información al respecto, pero ahora solo se deben anotar los datos más interesantes.
Fórmula
Cómo se ve se puede ver en la imagen de abajo. La fórmula química del ácido acético es simple. Esto se debe a muchas cosas: el compuesto en sí es monobásico y pertenece al grupo carboxilo, que se caracteriza por una fácil eliminación de protones (partícula elemental estable). Este compuesto es un representante típico de los ácidos carboxílicos, ya que tiene todas sus propiedades.
El enlace entre el oxígeno y el hidrógeno (−COOH) es altamente polar. Esto provoca un fácil proceso de disociación (disolución, descomposición) de estos compuestos y la manifestación de sus propiedades ácidas.
Como resultado, se forman el protón H+ y el ion acetato CH3COO −. ¿Cuáles son estas sustancias? Un ion acetato es un ligando unido a un aceptor específico (un objeto que recibe algo de un compuesto donante) que forma complejos de acetato estables con muchos cationes metálicos. Y un protón es, como se mencionó anteriormente, una partícula capaz de capturar un electrón con un electrón M-, K- o L-capas de un átomo.
Analisis cualitativo
Se basa precisamente en la disociación del ácido acético. El análisis cualitativo, también llamado reacción, es un conjunto de métodos físicos y químicos que se utilizan para detectar compuestos, radicales (moléculas y átomos independientes) y elementos (conjuntos de partículas) que componen el analito.
Usando este método, es posible detectar sales de ácido acético. No parece tan difícil como podría parecer. Se agrega un ácido fuerte a la solución. azufre, por ejemplo. Y si aparece el olor a ácido acético, entonces su sal está presente en la solución. ¿Cómo funciona? Los residuos de ácido acético, que se forman a partir de la sal, se asocian en ese momento con cationes de hidrógeno del ácido sulfúrico. Cual es el resultado? La aparición de más moléculas de ácido acético. Así es como ocurre la disociación.
reacciones
Cabe señalar que el compuesto en discusión es capaz de interactuar con metales activos. Estos incluyen litio, sodio, potasio, rubidio, francio, magnesio, cesio. Este último, por cierto, es el más activo. ¿Qué sucede durante estas reacciones? Se libera hidrógeno y se forman los notorios acetatos. Esta es la fórmula química del ácido acético que reaccionó con magnesio: Mg + 2CH 3 COOH → (CH 3 COO) 2 Mg + H 2.

Hay formas de obtener ácidos dicloroacético (CHCl 2 COOH) y tricloroacético (CCl 3 COOH). En ellos, los átomos de hidrógeno del grupo metilo son reemplazados por cloro. Solo hay dos formas de conseguirlos. Uno es la hidrólisis del tricloroetileno. Y es menos común que el otro, basado en la capacidad del ácido acético para ser clorado por la acción del cloro gaseoso. Este método es más simple y más eficiente.
Así es como se ve este proceso en forma de una fórmula química de ácido acético que interactúa con el cloro: CH 3 COOH + Cl 2 → CH 2 CLCOOH + HCL. Solo vale la pena aclarar un punto: esto es solo ácido cloroacético, los dos anteriores se forman con la participación de fósforo rojo en pequeñas cantidades.
Otras transformaciones
Vale la pena señalar que el ácido acético (CH3COOH) es capaz de participar en todas las reacciones que son características del notorio grupo carboxílico. Se puede reducir a etanol, un alcohol monohídrico. Para ello, es necesario actuar sobre él con hidruro de litio y aluminio, un compuesto inorgánico que es un potente agente reductor, muy utilizado en síntesis orgánica. Su fórmula es Li (AlH 4).

Además, el ácido acético se puede convertir en un cloruro de ácido, un agente acilante activo. Esto sucede bajo la influencia del cloruro de tionilo. Por cierto, es un cloruro de ácido sulfúrico. Su fórmula es H 2 SO 3. También vale la pena señalar que la sal de sodio del ácido acético se descarboxila cuando se calienta con álcali (se excluye la molécula de dióxido de carbono), lo que resulta en la formación de metano (CH₄). Y él, como saben, es el hidrocarburo más simple, que es más liviano que el aire.
Cristalización
Ácido acético glacial: el compuesto en cuestión a menudo se llama así. El hecho es que cuando se enfría a solo 15-16 ° C, pasa a un estado cristalino, como si se congelara. Visualmente, es realmente muy similar al hielo. Con varios ingredientes, puede realizar un experimento, cuyo resultado será la transformación del ácido acético en glacial. Todo es simple. Con agua y hielo, debe preparar una mezcla refrescante y luego colocar un tubo de ensayo preparado de antemano con ácido acético. Después de unos minutos, cristaliza. Además de la conexión, esto requiere un vaso de precipitados, un trípode, un termómetro y un tubo de ensayo.
Daño de sustancia
El ácido acético, cuya fórmula química y propiedades se mencionaron anteriormente, no es seguro. Sus vapores irritan las mucosas de las vías respiratorias superiores. El umbral para la percepción del olor de este compuesto, que se encuentra en el aire, está en la región de 0,4 mg/l. Pero también existe el concepto de concentración máxima permisible, un estándar sanitario e higiénico aprobado por ley. Según él, hasta 0,06 mg/m³ de esta sustancia pueden estar en el aire. Y si estamos hablando de locales de trabajo, entonces el límite aumenta a 5 mg / m 3.

El efecto destructivo del ácido en los tejidos biológicos depende directamente de cuánto se diluya con agua. Las soluciones que contienen más del 30% de esta sustancia son las más peligrosas. Y si una persona entra accidentalmente en contacto con un compuesto concentrado, no podrá evitar las quemaduras químicas. Esto categóricamente no se puede permitir, porque después de eso comienza a desarrollarse la necrosis por coagulación, la muerte de los tejidos biológicos. La dosis letal es de sólo 20 ml.
Consecuencias
Es lógico que cuanto mayor sea la concentración de ácido acético, más daño tendrá si entra en contacto con la piel o el interior del cuerpo. Los síntomas comunes de intoxicación incluyen:
- Acidosis. El equilibrio ácido-base se desplaza hacia un aumento de la acidez.
- Engrosamiento de la sangre y violación de su coagulabilidad.
- La hemólisis de los eritrocitos, su destrucción.
- Daño hepático.
- Hemoglobinuria. La hemoglobina aparece en la orina.
- Choque por quemadura tóxica.
Gravedad
Es costumbre distinguir tres:
- Luz. Se caracteriza por pequeñas quemaduras del esófago y la cavidad bucal. Pero no hay coagulación de la sangre y los órganos internos continúan funcionando normalmente.
- Promedio. Hay intoxicación, shock y coágulos de sangre. El estómago se ve afectado.
- Pesado. El tracto respiratorio superior, las paredes del tracto digestivo se ven gravemente afectadas, se desarrolla insuficiencia renal. Choque de dolor máximo. Posible desarrollo de una enfermedad por quemaduras.

También es posible la intoxicación por vapor de ácido acético. Se acompaña de secreción nasal intensa, tos y lagrimeo.
dando ayuda
Si una persona ha sido intoxicada por ácido acético, es muy importante actuar con rapidez para minimizar las consecuencias de lo sucedido. Considere lo que debe hacerse:
- Enjuágate la boca. No trague agua.
- Hacer un lavado gástrico. Tomará 8-10 litros de agua fría. Incluso las impurezas de la sangre no son una contraindicación. Porque en las primeras horas del envenenamiento, los grandes vasos aún permanecen intactos. Entonces no habrá sangrado peligroso. Antes de lavar, debe hacer anestesia con analgésicos. La sonda está lubricada con aceite de vaselina.
- ¡No induzca el vomito! Puede neutralizar la sustancia con magnesia quemada o Almagel.
- ¿Ninguna de las anteriores? Luego, a la víctima se le da hielo y aceite de girasol; debe tomar algunos sorbos.
- Está permitido que las víctimas usen una mezcla de leche y huevos.
Es importante brindar primeros auxilios dentro de las dos horas posteriores al incidente. Después de este período, las membranas mucosas se hinchan fuertemente y será difícil reducir el dolor de una persona. Y sí, nunca uses bicarbonato de sodio. La combinación de ácido y álcali dará una reacción que producirá dióxido de carbono y agua. Y tal formación dentro del estómago puede conducir a la muerte.
Solicitud
Las soluciones acuosas de ácido etanoico se utilizan ampliamente en la industria alimentaria. Estos son vinagres. Para obtenerlos, el ácido se diluye con agua para obtener una solución al 3-15%. Como aditivo, están etiquetados como E260. Los vinagres forman parte de diversas salsas, y también se utilizan para conservar alimentos, marinar carnes y pescados. En la vida cotidiana, son ampliamente aplicables para eliminar escamas, manchas de ropa y platos. El vinagre es un excelente desinfectante. Pueden tratar cualquier superficie. A veces se agrega al lavado para suavizar la ropa.

El vinagre también es aplicable en la producción de sustancias aromáticas, medicamentos, solventes, en la producción de acetona y acetato de celulosa, por ejemplo. Sí, y el ácido acético está directamente involucrado en el teñido y el estampado.
Además, se utiliza como medio de reacción para la oxidación de diversas sustancias orgánicas. Un ejemplo industrial es la oxidación de paraxileno (un hidrocarburo aromático) con oxígeno atmosférico a ácido aromático tereftálico. Por cierto, dado que los vapores de esta sustancia tienen un olor fuerte e irritante, se puede usar como sustituto del amoníaco para sacar a una persona de un desmayo.
Ácido acético sintético
Es un líquido inflamable, que pertenece a las sustancias de la tercera clase de peligro. Se utiliza en la industria. Cuando se trabaja con él, se utiliza equipo de protección personal. Almacene esta sustancia en condiciones especiales y solo en un recipiente determinado. Por regla general, esto es:
- tanques ferroviarios limpios;
- contenedores;
- camiones cisterna, barriles, contenedores de acero inoxidable (capacidad hasta 275 dm 3);
- botellas de vidrio;
- barriles de polietileno con una capacidad de hasta 50 dm3;
- tanques de acero inoxidable sellados herméticamente.

Si el líquido se almacena en un recipiente de polímero, entonces esto es un máximo de un mes. Además, el almacenamiento conjunto de esta sustancia con agentes oxidantes tan fuertes como el permanganato de potasio, los ácidos sulfúrico y nítrico está categóricamente prohibido.
La composición del vinagre.
También vale la pena decir algunas palabras sobre él. La composición del vinagre tradicional y familiar incluye los siguientes ácidos:
- Manzana. Fórmula: NOOSCH₂CH(OH)COOH. Es un aditivo alimentario común (E296) de origen natural. Contenido en manzanas verdes, frambuesas, fresnos de montaña, agracejos y uvas. En tabaco y cormoranes se presenta en forma de sales de nicotina.
- Lácteos. Fórmula: CH₃CH(OH)COOH. Se forma a partir de la descomposición de la glucosa. Complemento alimenticio (E270), que se obtiene por fermentación del ácido láctico.
- ascórbico. Fórmula: C₆H₈O₆. Aditivo alimentario (E300) utilizado como antioxidante que evita la oxidación del producto.
Y, por supuesto, el compuesto de etano también está incluido en la composición del vinagre: esta es la base de este producto.
¿Cómo diluir?
Esta es una pregunta frecuente. Todo el mundo ha visto a la venta ácido acético al 70%. Se compra para preparar mezclas para el tratamiento popular, o para usar como condimento, adobo, aditivo de salsas o para costuras. Pero no puedes usar un concentrado tan poderoso. Por lo tanto, surge la pregunta de cómo diluir el ácido acético en vinagre. Primero debe protegerse: use guantes. Luego se debe preparar agua limpia. Para soluciones de varias concentraciones, se requerirá una cierta cantidad de líquido. ¿Cual? Bueno, mire la tabla a continuación y diluya el ácido acético según los datos.
Concentración de vinagre | Concentración inicial de vinagre 70% |
1:1,5 (proporción: una parte de vinagre por la enésima parte de agua) |
|
En principio, nada complicado. Para obtener una solución al 9%, debe tomar la cantidad de agua en mililitros de acuerdo con esta fórmula: multiplique 100 gramos de vinagre por el indicador inicial (70%) y divida por 9. ¿Qué sucede? El número es 778. Se resta 100 de esto, ya que originalmente se tomaron 100 gramos de ácido. Resulta 668 mililitros de agua. Esta cantidad se mezcla con 100 g de vinagre. El resultado es una botella entera de solución al 9%.
Aunque, puede ser aún más fácil actuar. Muchos están interesados en cómo hacer vinagre a partir de ácido acético. ¡Fácilmente! Lo principal es recordar que para una parte de una solución al 70%, debe tomar 7 partes de agua.
Uno de los primeros ácidos que se dieron a conocer en la antigüedad fue el ácido acético. Fue descubierto por accidente, debido a la aparición de vinagre durante la acidificación del vino. En 1700, Stahl recibió una versión concentrada de la variedad química del líquido, y en 1814, Berzelius estableció su composición exacta.
La obtención de ácido acético es posible de diferentes formas, y su uso es bastante amplio en muchas áreas de la actividad económica.
El ácido acético es un producto sintético de la fermentación de carbohidratos y alcoholes, así como del agriado natural de los vinos de uva seca. Este ácido, que participa en el proceso de metabolismo del cuerpo humano, es un aditivo alimentario utilizado para la preparación de adobos y conservas.
Los derivados ácidos son vinagre - 3-9% y esencia de vinagre - 70-80%. Los ésteres y las sales del ácido acético se denominan acetatos. La composición del vinagre común, al que está acostumbrada toda ama de casa, incluye ácidos ascórbico, láctico, málico y acético. Casi 5 millones de toneladas de ácido acético se producen anualmente en el mundo.
El transporte de ácido a diferentes distancias se lleva a cabo en tanques de ferrocarril o camiones hechos de grados especiales de acero inoxidable. En condiciones de almacén, se almacena en contenedores sellados, contenedores, barriles debajo de cobertizos o en interiores. Es posible verter y almacenar la sustancia en un recipiente de polímero durante un mes calendario.
Características cualitativas del ácido acético.
El líquido incoloro con sabor agrio y olor acre, que es el ácido acético, tiene una serie de ventajas específicas. Las propiedades específicas hacen que el ácido sea indispensable en muchos compuestos químicos y productos para el hogar.

El ácido acético, como uno de los representantes de los ácidos carboxílicos, tiene la capacidad de exhibir una alta reactividad. Entrando en reacciones con una variedad de sustancias, el ácido se convierte en el iniciador de compuestos con derivados funcionales. Gracias a tales reacciones, se hace posible:
- Formación de sal;
- Formación de amidas;
- La formación de ésteres.
Hay una serie de requisitos técnicos específicos para el ácido acético. El líquido debe disolverse en agua, no tener impurezas mecánicas y tener las proporciones establecidas de componentes de calidad.
Las principales áreas de aplicación del ácido acético E-260
La variedad de áreas en las que se aplica el ácido acético es bastante grande. Este ácido es un componente indispensable de muchas drogas, por ejemplo, fenacetina, aspirina y otras variedades. Las aminas aromáticas del grupo NH2 se protegen durante la nitración mediante la introducción de un grupo acetilo de CH3CO; esta es también una de las reacciones más comunes en las que entra ácido acético.
La sustancia juega un papel bastante importante en la fabricación de acetato de celulosa, acetona y varios tintes sintéticos. La producción de varios perfumes y películas no combustibles no está completa sin su participación.

El ácido acético se usa a menudo en la industria alimentaria, como aditivo alimentario E-260. Las conservas y la cocina casera también son campos de éxito de acción y aplicación de un complemento natural de calidad.
Al teñir, los principales tipos de sales de ácido acético desempeñan el papel de mordientes especiales, proporcionando una unión estable entre las fibras textiles y el tinte. Estas sales se utilizan a menudo en la lucha contra las variedades de plagas más persistentes.
Precauciones al trabajar con ácido acético
El ácido acético se considera un líquido inflamable, al que se le asigna la tercera clase de peligro, de acuerdo con la clasificación de sustancias según el grado de efectos peligrosos en el cuerpo. En cualquier trabajo con este tipo de ácido, los especialistas utilizan modernos equipos de protección individuales (máscaras antigás filtrantes).

Incluso el aditivo alimentario E-260 puede ser tóxico para el cuerpo humano, pero el grado de exposición dependerá de la calidad de la dilución con ácido acético concentrado con agua. Las soluciones que contienen más del 30 % de concentración de ácido se consideran peligrosas para la vida. En contacto con la piel y las membranas mucosas, el ácido acético en alta concentración causa quemaduras químicas graves.
Al mismo tiempo, el método de obtención del ácido no juega un papel especial en su orientación toxicológica, y una dosis de 20 ml puede ser fatal. Varias consecuencias pueden ser perjudiciales para muchos órganos humanos, desde la mucosa oral y el tracto respiratorio hasta el estómago y el esófago.
Si se ingiere ácido sin darse cuenta, es importante beber la mayor cantidad de líquido posible antes de la llegada de los médicos, pero en ningún caso inducir el vómito. El paso repetido de sustancias a través del cuerpo puede volver a quemar los órganos. En el futuro, será necesario lavar el estómago con una sonda y hospitalización.
Características generales del ácido acético
Sinónimos: ácido etanoico, ácido acético glacial, ácido acético, CH 3 COOHEste es un compuesto orgánico. Tiene un sabor agrio característico y un olor acre. Aunque está clasificado como un ácido débil, el ácido acético concentrado es corrosivo.
En estado sólido, las moléculas de ácido acético forman pares (dímeros) conectados por puentes de hidrógeno. El ácido acético líquido es un solvente prótico hidrofílico (polar) similar al etanol y al agua. Con una permitividad estática relativa moderada (constante dieléctrica) de 6,2, no solo disuelve compuestos polares como sales inorgánicas y azúcares, sino también compuestos no polares como aceites y elementos como azufre y yodo. En el ácido acético, el centro de hidrógeno se encuentra en el grupo carboxilo (-COOH), como en otros ácidos carboxílicos, se puede separar de la molécula por ionización:
CH 3 CO 2 H → CH 3 CO 2 - + H +
El ácido acético puede entrar en reacciones químicas típicas de los ácidos carboxílicos. Al interactuar con una base, se convierte en acetato de metal y agua. La reducción del ácido acético da etanol. Cuando se calienta a más de 440 °C, el ácido acético se descompone para producir dióxido de carbono y metano, o cetenas y agua:
CH 3 COOH → CH 4 + CO 2
CH 3 COOH → CH 2 CO + H 2 O
Obtener ácido acético
El ácido acético es secretado por las bacterias del ácido acético (Acetobacter del género Clostridium y acetobutylicum):C 2 H 5 OH + O 2 → CH 3 COOH + H 2 O
Aproximadamente el 75% del ácido acético se sintetiza para su uso en la industria química mediante la carbonilación del metanol. En este proceso, el metanol y el monóxido de carbono reaccionan para producir ácido acético:
CH 3 OH + CO → CH 3 COOH
El uso de ácido acético.
El ácido acético es un reactivo químico para la producción de compuestos químicos. El uso más común del ácido acético es en la producción de monómero de acetato de vinilo (VAM). El ácido acético se utiliza como disolvente en la producción de ácido tereftálico (TPA), materia prima del tereftalato de polietileno (PET).Los ésteres de ácido acético se usan comúnmente como solventes para tintas, pinturas y recubrimientos. Los ésteres incluyen acetato de etilo, acetato de n-butilo, acetato de isobutilo y acetato de propilo.
El ácido acético glacial se utiliza en química analítica para evaluar sustancias débilmente alcalinas como las amidas orgánicas. El ácido acético glacial es mucho más débil que el agua, por lo que la amida se comporta como una base fuerte en este entorno.
El vinagre (4-18% de ácido acético) se usa directamente como condimento.