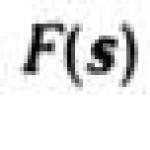К методам исследования строения вещества относятся. Курсовая работа методы исследования органических соединений. Измерение напряжения при деформации
Введение
Эксперементальные методы
1 Рентгеноэлектронная спектроскопия
1.2 Ифракрасная спектроскопия
1.3 Дифракционные методы
Теоретические методы
1 Полуэмпирические методы
2 Неэмпирические методы
3 Кванто-механические методы
4 Метод Хюккеля
Заключение
Список использованных источников
ВВЕДЕНИЕ
В современной органической химии большое значение имеют различные физические методы исследования. Их можно разделить на две группы. К первой группе относятся методы, позволяющие получать различные сведения о строении и физических свойствах вещества, не производя в нем никаких химических изменений. Из методов этой группы, пожалуй, наибольшее применение получила спектроскопия в широком диапазоне областей спектра - от не слишком жестких рентгеновских лучей до радиоволн не очень большой длины. Ко второй группе относятся методы, в которых используются физические воздействия, вызывающие химические изменения в молекулах. В последние годы к ранее применявшимся широкоизвестным физическим средствам воздействия на реакционную способность молекулы прибавились и новые. Среди них особое значение имеют воздействия жестких рентгеновских лучей и потоков частиц больших энергий, получаемых в атомных реактора
Целью данной курсовой работы является - узнать о методах исследований строения молекул.
Задача курсовой работы:
выяснить виды методов и изучить их.
1. ЭКСПЕРЕМЕНТАЛЬНЫЕ МЕТОДЫ
1.1 Рентгеноэлектронная спектроскопия
Рисуник 1- Схема электронного
спектрометра: 1-источник излучения; 2-образец; 3- анализатор; 4-детектор;
5-экран для защиты от магнитного поля
Рисунок 2- Рентгеноэлектронный
спектр Сls этилтрифторацетата
РЭС позволяет исследовать все элементы, кроме Н, при содержании их в образце ~ 10 -5 г (пределы обнаружения элемента с помощью РЭС 10 -7 -10 -9 г). Относительное содержание элемента может составлять доли процента. Образцы могут быть твердыми, жидкими или газообразными. Величина E св электрона <#"606051.files/image003.gif">
![]()
По такой же формуле
рассчитывают и атомный фактор, при этом описывает распределение рассеивающей
плотности внутри атома.
Значения атомного фактора специфичны для каждого вида излучения. Рентгеновские
лучи рассеиваются электронными оболочками атомов. Соответствующий атомный
фактор численно равен числу электронов в атоме, если выражен в названии электронных единицах, т. е. в
относительных единицах амплитуды рассеяния рентгеновского излучения одним
свободном электроне. Рассеяние электронов
определяется электростатическим потенциалом атома. Атомный фактор для электрона связан
соотношением:

исследование молекула спектроскопия
дифракционный квантовый

Рисунок 2- Зависимость абсолютных значений атомных факторов рентгеновских лучей (1), электронов (2) и нейтронов (3) от угла рассеяния
Рисунок 3-
Относительная зависимость усредненных по углу атомных факторов рентгеновских
лучей (сплошная линия), электронов
(штриховая)и нейтронов от атомного номера Z
При точных расчетах
рассматривают отклонения распределения электронной плотности или потенциала атомов
от сферической симметрии и название атомно-температурный фактор, учитывающий
влияние тепловых колебаний атомов на
рассеяние. Для излучения помимо рассеяния на электронных оболочках атомов существует роль может играть резонансное рассеяние на
ядрах. Фактор рассеяния f м зависит от волновых векторов и векторов поляризации падающей и рассеянной волн. Интенсивность I(s) рассеяния
объектом пропорциональна квадрату модуля амплитуды: I(s)~|F(s)| 2 .
Экспериментально можно определить лишь модули |F(s)|, а для построения функции
рассеивающей плотности (r) необходимо знать также фазы (s) для каждого s. Тем
не менее теория дифракционных методов позволяет по измеренным I(s) получить
функцию (r), т. е. определить структуру веществ. При этом лучшие результаты
получают при исследовании кристаллов. Структурный
анализ.
Монокристалл представляет собой строго упорядоченную систему, поэтому
при дифракции образуются лишь дискретные рассеянные пучки, для которых вектор рассеяния равен вектору
обратной решетки.
Для построения функции (х, у, z)по экспериментально определяемым величинам применяют метод проб и ошибок, построение и анализ функции межатомных расстояний, метод изоморфных замещений, прямые методы определения фаз. Обработка экспериментальных данных на ЭВМ позволяет восстанавливать структуру в виде карт распределения рассеивающей плотности. Структуры кристаллов изучают с помощью рентгеновского структурного анализа. Этим методом определено более 100 тысяч структур кристаллов.
Для неорганических кристаллов с применением различных методов уточнения (учет поправок
на поглощение, анизотропию
атомно-температурного фактора и т. д.) удается восстановить функцию с
разрешением до 0.05

Рисунок 4- Проекция ядерной
плотности кристаллической структуры
Это позволяет определять анизотерапию тепловых колебаний атомов, особенности распределения электронов, обусловленные химической связью, и т. д. С помощью рентгеноструктурного анализа удается расшифровывать атомные структуры кристаллов белков, молекулы которых содержат тысячи атомов. Дифракция рентгеновских лучей используется также для изучения дефектов в кристаллах (в рентгеновской топографии), исследования приповерхностных слоев (в рентгеновской спектрометрии), качественного и количественного определения фазового состава поликристаллических материалов. Электронография как метод изучения структуры кристаллов имеет след. особенности: 1) взаимодействие вещества с электронами намного сильнее, чем с рентгеновскими лучами, поэтому дифракция происходит в тонких слоях вещества толщиной 1 -100 нм; 2) f э зависит от атомного ядра слабее, чем f р, что позволяет проще определять положение легких атомов в присутствии тяжелых; Структурная электронография широко применяется для исследования тонкодисперсных объектов, а также для изучения разного рода текстур (глинистые минералы, пленки полупроводников и т. п.). Дифракция электронов низких энергий (10 -300 эВ, 0.1-0.4 нм) - эффективный метод исследования поверхностей кристаллов: расположения атомов, характера их тепловых колебаний и т. д. Электронная микроскопия восстанавливает изображение объекта по дифракционной картине и позволяет изучать структуру кристаллов с разрешением 0.2-0.5 нм. Источниками нейтронов для структурного анализа служат ядерные реакторы на быстрых нейтронах, а также импульсные реакторы. Спектр пучка нейтронов, выходящих из канала реактора, непрерывен вследствие максвелловского распределения нейтронов по скоростям (его максимум при 100°С соответствует длине волны 0.13 нм).
Монохроматизацию пучка осуществляют
разными способами - с помощью кристаллов-монохроматоров и др. Нейтронографию используется, как правило, для уточнения и дополнения
рентгеноструктурных данных. Отсутствие монотонной зависимости f и от
атомного номера позволяет достаточно точно определять
положение легких атомов. Кроме того, изотопы одного в того же элемента могут иметь сильно различающиеся
значения f и (так, f и углеводорода 3.74.10 13
см, у дейтерия 6.67.10 13 см). Это
дает возможность изучать расположение изотопов
и получать дополнит. сведения о структуре путем изотопного замещения.
Исследование магнитного взаимодействия. нейтронов с магнитнами моментами атомов дает
информацию о спинах магнитного атомов. Мёссбауэровское -излучение отличается чрезвычайно малой
шириной линии - 10 8 эВ (тогда как ширина линии характеристических
излучения рентгеновских трубок. 1 эВ). Это обусловливает высокую временную и
пространств. согласованность резонансного ядерного рассеяния, что позволяет, в
частности, изучать магнитное поле и градиент электрического поля на ядрах.
Ограничения метода - слабая мощность мёссбауэровских источников и обязательное
присутствие в исследуемом кристалле ядер, для
которых наблюдается эффект Мёссбауэра. Структурный анализ некристаллическихвеществ.Отдельные молекулы в газах, жидкостях и твердых аморфных телах по-разному ориентированы в
пространстве, поэтому определить фазы рассеянных волн, как правило, невозможно.
В этих случаях интенсивность рассеяния обычно представляют с помощью т. наз.
межатомных векторов r jk , которые
соединяют пары различных атомов (j и k) в молекулах: r jk =
r j - r k . Картина рассеяния усредняется по всем
ориентациям:

.1
Полуэмпирические методы
Полуэмпирические методы квантовой химии, методы расчета мол. характеристик или свойств вещества с привлечением экспериментальных данных. По своей сути полуэмпирические методы аналогичны неэмпирическим методам решения уравнения Шрёдингера для многоатомных систем, однако для облегчения расчетов в полуэмпирических методах вводятся дополнит. упрощения. Как правило, эти упрощения связаны с валентным приближением, т. е. основаны на описании лишь валентных электронов, а также с пренебрежением определенными классами молекулярных интегралов в точных уравнениях того неэмпирического метода, в рамках которого проводится полуэмпирический расчет.
Выбор эмпирических параметров основан на обобщении опыта неэмпирических расчетов, учете химических представлений о строении молекул и феноменологических закономерностей. В частности, эти параметры необходимы для аппроксимации влияния внутренних электронов на валентные, для задания эффективных потенциалов, создаваемых электронами остова, и т.п. Использование экспериментальных данных для калибровки эмпирических параметров позволяет устранить ошибки, обусловленные упомянутыми выше упрощениями, однако лишь для тех классов молекул, представители которых служат опорными молекулами, и лишь для тех свойств, по которым параметры определялись.
Наиболее распространены полуэмпирические методы,
основанные на представлениях о мол. орбиталях (см. Молекулярных орбиталей
методы, Орбиталь). В сочетании с ЛКАО-приближением это позволяет выразить
гамильтониан молекулы через интегралы на атомных орбиталях. При построении
полуэмпирических методов в мол. интегралах выделяют произведения орбиталей,
зависящих от координат одного и того же электрона (дифференциальное перекрывание),
и пренебрегают некоторыми классами интегралов. Напр., если нулевыми считаются
все интегралы, содержащие дифференциальное перекрывание cаcb при а. b,
получается т. наз. метод полного пренебрежения дифференциала. перекрыванием
(ППДП, в англ. транскрипции CNDO-complete neglect of differential overlap).
Применяют также частичное или модифицированное частичное пренебрежение
дифференциальное перекрыванием (соотв. ЧПДП или МЧПДП, в английской
транскрипции INDO- intermediate neglect of differential overlap и
MINDO-modified INDO), пренебрежение двухатомным дифференциальное перекрыванием
- ПДДП, или neglect of diatomic differential overlap (NDDO), - модифицирование
пренебрежение двухатомным перекрыванием (МПДП, или modified neglect of diatomic
overlap, MNDO). Как правило, каждый из полуэмпирических методов имеет несколько
вариантов, которые принято указывать в названии метода цифрой или буквой после
косой черты. Напр., методы ППДП/2, МЧПДП/3, МПДП/2 параметризованы для расчетов
равновесной конфигурации ядер молекулы в основном электронном состоянии,
распределения заряда, потенциалов ионизации, энтальпий образования химических
соединений, метод ЧПДП используется для расчета спиновых плотностей. Для
расчета энергий электронного возбуждения применяют спектроскопическую
параметризацию (метод ППДП/С). Распространено также использование в названиях
полуэмпирических методов соответствующих программ для ЭВМ. Напр., один из
расширенных вариантов метода МПДП называют Остинской моделью, как и
соответствующую программу (Austin model, AM). Имеется несколько сотен различных
вариантов полуэмпирических методов, в частности разработаны полуэмпирические
методы, аналогичные конфигурационного взаимодействия методу. При внешних
схожести разных вариантов полуэмпирических методов каждый из них можно
применять для расчета лишь тех свойств, по которым проведена калибровка
эмпирических параметров. В наиб. простых Полуэмпирических расчетах каждая мол.
орбиталь для валентных электронов определяется как решение одноэлектронного
уравнения Шрёдингера с оператором Гамильтона, содержащим модельный потенциал
(псевдопотенциал) для электрона, находящегося в поле ядер и усредненном поле
всех остальных электронов системы. Такой потенциал задают непосредственно с
помощью элементарных функций или основанных на них интегральных операторов. В
сочетании с ЛКАО-приближением подобный подход позволяет для многих сопряженных
и ароматического мол. систем ограничиться анализом p-электронов (см. Хюккеля
метод), для координационной соединений-пользоваться расчетными методами поля
лигандов теории и кристаллического поля теории и т.п. При изучении
макромолекул, напр. белков, или кристаллических образований нередко пользуются
полуэмпирическими методами, в которых электронное строение не анализируется, а
определяется непосредственно поверхность потенциальной энергии. Энергию системы
приближенно считают суммой парных потенциалов взаимодействия атомов, напр.
потенциалов Морса (Морзе) или Леннард-Джонса (см. Меж молекулярные
взаимодействия). Такие полуэмпирические методы позволяют проводить расчет
равновесной геометрии, конформационных эффектов, энергии изомеризации и т.п.
Нередко парные потенциалы дополняют определенными для отдельных фрагментов
молекулы многочастичными поправками. Полуэмпирические методы такого типа, как
правило, относят к молекулярной механике. В более широком смысле к
полуэмпирическим методам относятся любые методы, в которых определенные
решением обратных задач параметры мол. системы используются для предсказаний
новых экспериментальных данных, построения корреляционных соотношений. В этом
смысле полуэмпирическими методами являются методы оценки реакционной
способности, эффективных зарядов на атомах и т. п. Сочетание полуэмпирического
расчета электронного строения с корреляц. соотношениями позволяет оценивать
биологическую активность различных веществ, скорости химических реакций,
параметры технологических процессов. К полуэмпирическим методам относятся и
некоторые аддитивные схемы, напр. применяемые в химической термодинамике методы
оценки энергии образования как суммы вкладов отдельных фрагментов молекулы.
Интенсивное развитие полуэмпирических методов и неэмпирических методов
квантовой химии делает их важными средствами современные исследования
механизмов хим. превращений, динамики элементарного акта хим. реакции,
моделирования биохимических и технологических процессов. При правильном
использовании (с учетом принципов построения и способов калибровки параметров)
полуэмпирические методы позволяют получить надежную информацию о строении и
свойствах молекул, их превращениях.
2.2Неэмпирические
методы
Принципиально иное направление расчетной квантовой химии, сыгравшее огромную роль в современном развитии химии в целом, состоит в полном или частичном отказе от вычисления одноэлектронных (3.18) и двухэлектронных (3.19)-(3.20) интегралов, фигурирующих в методе ХФ. Вместо точного оператора Фока используется приближенный, элементы которого получают эмпирическим путем. Параметры оператора Фока подбирают для каждого атома (иногда с учетом конкретного окружения) или для пар атомов: они либо являются фиксированными, либо зависят от расстояния между атомами. При этом часто (но не обязательно - см. ниже) предполагается, что многоэлектронная волновая функция является однодетерминантной, базис - минимальным, а атомные орбитали Х; - симметричными ортогональными комбинациями ОСТ Хг Такие комбинации легко получить, аппроксимируя исходные АО функциями Слейтера "Xj (2.41) с помощью преобразования Полуэмпирические методы работают гораздо быстрее, чем неэмпирические. Они применимы к большим (часто - к очень большим, например, биологическим) системам и для некоторых классов соединений дают более точные результаты. Однако следует понимать, что это достигается за счет специально подобранных параметров, справедливых лишь в пределах узкого класса соединений. При переносе на другие соединения те же методы могут дать абсолютно неверные результаты. Кроме того, параметры часто подбираются таким образом, чтобы воспроизводить только определенные молекулярные свойства, поэтому придавать физический смысл отдельным параметрам, используемым в схеме расчета, не следует. Перечислим основные приближения, используемые в полуэмпирических методах.
Рассматриваются только валентные электроны. Считают, что электроны, относящиеся к атомным остовам, лишь экранируют ядра. Поэтому влияние этих электронов учитывают, рассматривая взаимодействие валентных электронов с атомными остовами, а не с ядрами, и вводя энергию отталкивания остовов вместо энергии межъядерного отталкивания. Поляризацией остовов пренебрегают.
В МО учитывают только АО с главным квантовым числом, соответствующим высшим заселенным электронами орбиталям изолированных атомов (минимальный базис). Предполагают, что базисные функции образуют набор ортанормированных атомных орбиталей- ОСТ, ортогонализованных по Лёвдину.
Для двухэлектронных кулоновских и обменных интегралов вводят приближение нулевого дифференциального перекрывания (НДП) .
Молекулярной структуре в пределах структурной области может соответствовать набор модификаций молекулы, сохраняющих одинаковую систему валентных химических связей при разной пространствеиной организации ядер. В этом случае глубокий минимум ППЭ дополнительно имеет несколько неглубоких (эквивалентных или неэквивалентных по энергии) минимумов, разделенных небольшими потенциальными барьерами. Различные пространствеиные формы молекулы, преобразующиеся друг в друга в пределах данной структурной области путем непрерывного изменения координат атомов и функциональных групп без разрыва или образования химических связей, составляют множество конформаций молекулы. Набор конформаций, энергии которых меньше намнизшего барьера, примыкающего к данной структурной области ППЭ, называется конформационным изомером, или конформером. Конформеры, соответствующие локальным минимумам ППЭ, называются устойчивыми или стабильными. Таким образом, молекулярную структуру можно определить как совокупность конформаций молекулы в определенной структурной области Часто встречающимся в молекулах типом конформационного перехода является вращение отдельных групп атомов относительно связей: говорят, что имеет место внутреннее вращение, а различные конформеры называют вращательными изомерами, или ротамерами. При вращении меняется и электронная энергия, причем ее значение в процессе такого движения может проходить через максимум; в этом случае говорят о барьере внутреннего вращения. Последние во многом обусловлены способностью этих молекул легко адаптировать структуру при взаимодействии с разными системами. Каждому энергетическому минимуму ППЭ соответствует пара энантиомеров с одинаковой энергией - правый (R) и левый (S). Эти пары имеют энергии, отличающиеся всего на 3.8 ккал/моль, однако они разделены барьером высотой 25.9 ккалjмоль и, следовательно, весьма устойчивы при отсутствии внешних воздействий. Результаты квантово-химических расчетов энергий барьеров внутреннего вращения для некоторых молекул и соответствующие экспериментальные значения. Теоретические и экспериментальные величины барьеров вращения для связей С-С, С-Р, C-S отличаются всего на 0.1 ккал/моль; для связей С-0, C-N, C-Si, несмотря на использование базисного набора с включением поляризационных функций (см. ниже), разница заметно выше. 1"ем не менее, можно констатировать удовлетворительную точность расчета энергий барьеров внутреннего вращения методом ХФ.
Подобные расчеты энергий барьеров внутреннего
вращения для простых молекул помимо спектроскопических приложений важны как
критерий качества того или иного расчетного метода. Большого внимания
заслуживает внутреннее вращение в сложных молекулярных системах, например, в
полипептидах и белках, где этот эффект обусловливает мноmе биологически важные
функции этих соединений. Вычисление поверхностей потенциальной энергии для
таких объектов представляет собой сложную задачу как в теоретическом, так и в
практическом плане. Распространенным видом конформационного перехода является
инверсия, такая, какая имеет место в пирамидальных молекулах типа АХ3 (А= N,
Si, Р, As, Sb; Х =Н, Li, F и др.). В этих молекулах атом А может занимать
позиции как выше, так и ниже плоскости, образованной тремя атомами Х. Например,
в молекуле аммиака NH3 метод ХФ дает величину энергетического барьера, равную
23,4 ккал/моль; это неплохо согласуется с экспериментальным значением барьера
инверсии - 24.3 ккал/моль. Если барьеры между минимумами ППЭ сопоставимы с
тепловой энергией молекулы, это приводит к эффекту структурной нежесткости
молекулы; конформационные переходы в таких молекулах происходят постоянно. Для
решения уравнений ХФ применяется метод самосогласованного поля. В процессе
решения оптимизируются только орбитали, занятые электронами, следовательно,
энергии лишь этих орбиталей находят физически обоснованно. Однако метод. ХФ
дает и характеристики свободных орбиталей: такие молекулярные спин-орбитали
называются виртуальными. К сожалению, они описывают возбужденные энергетические
уровни молекулы с погрешностью около 100%, и применять их для трактовки
спектроскопических данных следует с осторожностью - для этого существуют другие
методы. Также как и для атомов, метод ХФ для молекул имеет различные версии, в
зависимости от того, является ли однодетерминантная волновая функция
собственной функцией оператора квадрата полного спина системы S2 или нет. Если
волновая функция построена из пространствеиных орбиталей, занятых парой электронов
с противоположными спинами (молекулы с замкнутыми оболочками), это условие
выполняется, а метод называется ограниченным методом Хартри-Фока (ОХФ). Если
требование быть собственной функцией оператора на волновую функцию не
накладывается, то каждая молекулярная спин-орбиталь отвечает определенному
спиновому состоянию (а или 13), то есть электроны с противоположными спинами
занимают разные спин-орбитали. Такой метод обычно применяется для молекул с
открытыми оболочками и называется неограниченным методом ХФ (НХФ), или методом
разных орбиталей для разных спинов. Иногда низколежащие энергетические
состояния описывают орбиталями, дважды занятыми электронами, а валентные
состояния описывают однократно занятыми молекулярными спин-орбиталями; этот
метод назьmается ограниченным методом Хартри-Фока для открытых оболочек (ОХФ-
00). Как и в атомах волновая функция молекул с открытыми оболочками не
соответствует чистому спиновому состоянию, и могут возникать решения, у которых
симметрия волновой функции по спину понижена. Они называются НХФ-нестабильными
решениями.
2.3 Квантово-механические методы
Успехи теоретической химии, развитие квантовой механики создали возможность приближенных количественных расчетов молекул. Известно два важнейших метода расчета: метод электронных пар, называемый также методом валентных связей, и метод молекулярных орбит. Первый из этих методов, разработанный Гейтлером и Лондоном для молекулы водорода, приобрел широкое распространение в 30-х годах нынешнего столетия. В последние годы все большее значение приобретает метод молекулярных орбит (Гунд, Э. Хюккель, Мулликен,Герц-берг, Ленард-Джонс).
В этом приближенном методе расчета состояние молекулы описывается так называемой волновой функцией ψ, которая составляется по определенному правилу из ряда слагаемых:
Сумма этих слагаемых должна учитывать все возможные комбинации, возникающие в результате попарного связывания атомов углерода за счет π-электронов.
Для того чтобы облегчить расчет волновой функции ψ, отдельные слагаемые (C1ψ1, C2ψ2 и т. д.) условно изображаются графически в виде соответствующих валентных схем, которые используются как вспомогательные средства при математическом расчете. Например, когда указанным способом рассчитывают молекулу бензола и принимают во внимание только π-элек-троны, то таких слагаемых получается пять. Этим слагаемым соответствуют следующие валентные схемы:
Часто приведенные валентные схемы изображают с учетом σ-связей, например для бензола
Такие валентные схемы называют «невозмущенными структурами» или «предельными структурами»
Функции ψ1, ψ2, ψ3 и т. д. различных предельных структур входят в волновую функцию ψ с тем большими коэффициентами (с тем большим весом), чем меньше энергия, рассчитанная для соответствующей структуры. Электронное состояние, соответствующее волновой функции ψ, наиболее устойчиво сравнительно с электронными состояниями, изображаемыми функциями ψ1, ψ2, ψ3 и т. д.; энергия же состояния, изображаемого функцией ψ (реальной молекулы), естественно, является наименьшей сравнительно с энергиями предельных структур.
При расчете молекулы бензола по методу электронных пар учитываются пять предельных структур (I-V). Две из них тождественны классической структурной формуле Кекуле и три-формуле Дьюара. Так как энергия электронных состояний, соответствующих предельным структурам III, IV и V, выше, чем для структур I и II, то вклад структур III, IV и V в смешанную волновую функцию молекулы бензола ψменьше, чем вклад структур I и II. Поэтому в первом приближении для изображения распределения электронной плотности в молекуле бензола достаточно двух эквивалентных структур Кекуле.
Предельные структуры не соответствуют каким-либо реальным электронным состояниям в невозбужденных молекулах, однако не исключено, что они могут осуществляться в возбужденном состоянии или в момент реакции.
Вышеизложенная качественная сторона теории резонанса совпадает с концепцией мезомерии, несколько ранее развитой Инголдом и независимо от него Арндтом.
Согласно этой концепции, истинное состояние молекулы является промежуточным («мезомерным») между состояниями, изображенными двумя или несколькими «предельными структурами», которые можно написать для данной молекулы, пользуясь правилами валентности.
Кроме этого основного положения теории мезомерии, к ее аппарату относятся хорошо разработанные представления об электронных смещениях, в обосновании, интерпретации и опытной проверке которых важная роль принадлежит Инголду. Согласно Инголду, механизмы электронных смещений (электронных эффектов) различны в зависимости от того, осуществляется ли взаимное влияние атомов через цепь простых или сопряженных двойных связей. В первом случае это - индукционный эффект I (или также статический индукционный эффект Is), во втором случае - мезомерный эффект М (статический эффект сопряжения).
В реагирующей молекуле электронное облако может поляризоваться по индукционному механизму; такое электронное смещение называется индуктомерным эффектом Id. В молекулах с сопряженными двойными связями (и в ароматических молекулах) поляризуемость электронного облака в момент реакции обусловлена электромерным эффектом E (динамический эффект сопряжения).
Теория резонанса не вызывает никаких принципиальных возражений, пока речь идет о способах изображения молекул, но она имеет и большие претензии. Аналогично тому, как в методе электронных, пар волновая функция описывается линейной комбинацией других волновых функций ψ1, ψ2, ψ3 и т. д., теория резонанса предлагает описывать истинную волновую функцию ψмолекулы в виде линейной комбинации волновых функций предельных структур.
Однако математика не дает критериев для выбора тех или иных «резонансных структур»: ведь в методе электронных пар волновую функцию можно представить не только как линейную комбинацию волновых функций ψ1, ψ2, ψ3 и т. д., но и как линейную комбинацию любых других функций, подобранных с определенными коэффициентами. Выбор же предельных структур может быть сделан только на основе химических соображений и аналогий, т. е. здесь концепция резонанса по существу не дает ничего нового по сравнению с концепцией мезомерии.
При описании распределения электронной плотности в молекулах с помощью предельных структур необходимо постоянно иметь в виду, что отдельно взятые предельные структуры не соответствуют какому-либо реальному физическому состоянию и что никакого физического явления «электронного резонанса» не существует.
Из литературы известны многочисленные случаи, когда сторонники концепции резонанса приписывали резонансу смысл физического явления и считали, что за определенные свойства веществ ответственны те или иные отдельные предельные структуры. Возможность возникновения таких ошибочных представлений заложена во многих пунктах концепции резонанса. Так, когда говорят о «различных вкладах предельных структур» в реальное состояние молекулы, легко может возникнуть представление о реальном существовании этих соотношений. Реальная молекула в концепции резонанса считается «резонансным гибридом»; этот термин может навести на мысль о якобы реальном взаимодействии предельных структур, подобно гибридизации атомных орбит.
Неудачен также термин «стабилизация за счет резонанса», так как стабилизация молекулы не может быть обусловлена несуществующим резонансом, а представляет собой физическое явление делокализации электронной плотности, характерное для сопряженных систем. Целесообразно поэтому это явление называть стабилизацией за счет сопряжения. Энергия сопряжения (энергия делокализации, или энергия мезомерии) может быть определена экспериментальным путем, независимо от «энергии резонанса», вытекающей из квантово-механических расчетов. Это - разность между энергией, вычисленной для гипотетической молекулы с формулой, соответствующей одной из предельных структур, и энергией, найденной экспериментально для реальной молекулы.
С указанными выше оговорками способ описания
распределения электронной плотности в молекулах с помощью нескольких предельных
структур несомненно может быть использован наряду с двумя другими также весьма
распространенными способами.
2.4
Метод Хюккеля
Хюккеля метод, квантовохимический метод приближенного расчета энергетических уровней и мол. орбиталей ненасыщенных орг. соединений. Основан на предположении, согласно которому движение электрона вблизи атомного ядра в молекуле не зависит от состояний или числа др. электронов. Это позволяет максимально упростить задачу определения мол. орбиталей (МО) в представлении линейной комбинацией атомных орбиталей. Метод предложен Э. Хюккелем в 1931 для расчета электронного строения углеводородов с сопряженными связями. Считается, что атомы углерода сопряженной системы лежат в одной плоскости, относительно которой высшие занятые и низшие виртуальные (свободные) МО (граничные мол. орбитали) антисимметричны, т. е. являются орбиталями, образованными атомными 2рz-орбиталями (АО) соответствующих атомов С. Влиянием остальных атомов, напр. Н, или мол. фрагментов с насыщенными связями пренебрегают. Предполагается, что каждый из М атомов углерода сопряженной системы вносит в систему один электрон и описывается одной атомной 2рz-орбиталью(k = 1, 2, ..., М). Простая модель электронного строения молекулы, даваемая Хюккеля методом, позволяет понять многие хим. явления. Например неполярность альтернантных углеводородов обусловлена тем, что эффективные заряды на всех атомах углерода равны нулю. Напротив, неальтернантная конденсированная система 5- и 7-членного циклов (азулен) имеет дипольный момент ок. 1Д (3.3 x 10 -30 Кл x м). В нечетных альтернантных углеводородах основное энергетическое. состояние отвечает электронной системе, в которой есть хотя бы одна однократно занятая орбиталь. Можно показать, что энергия этой орбитали та же, что и в свободном атоме, в связи с чем она наз. несвязывающей МО. Удаление или добавление электрона изменяет заселенность лишь несвязывающей орбитали, что влечет появление заряда на некоторых атомах, который пропорционален квадрату соответствующего коэффициент в разложении несвязывающей МО по АО. Для определения такой МО применяют простое правило: сумма коэффициент Ck для всех атомов, соседних с любым данным, должна быть равна нулю. Кроме того, значения коэффициент должны отвечать дополнит. условию нормировки: Это приводит к характерному чередованию (альтернированию) зарядов на атомах в мол. ионах альтернантных углеводородов. В частности, указанное правило объясняет выделение по хим. свойствам орто- и пара-положений в бензольном ядре по сравнению с мета-положением. Закономерности, установленные в рамках простого Хюккеля метода, искажаются при более полном учете всех взаимодействие в молекуле. Однако обычно влияние множества разнородных дополнит, факторов (например электронов остова, заместителей, межэлектронного отталкивания и т. п.) качественно не меняет орбитальную картину электронного распределения. Поэтому Хюккеля метод часто используют для моделирования сложных механизмов реакций с участием орг. соединений. При введении в молекулу гетероатомов (N, О, S, ...) существенными становятся параметры матрицы H, принимаемые для гетероатома и для атомов углерода. В отличие от случая полиенов, разные типы атомов или связей описываются разными параметрами или и их соотношение существенно влияет на вид МО; качество предсказаний, получаемых в рамках простого Хюккеля метода, как правило, в итоге ухудшается. Простой по своей идее, наглядный и не требующий сложных вычислений Хюккеля метод является одним из наиболее распространенных средств создания квантовохимической модели электронного строения сложных мол. систем. Наиб. эффективно его применение в тех случаях, когда свойства молекулы определяются в основные топологические структурой хим. связей, в частности симметрией молекулы. Попытки построить улучшенные варианты Хюккеля метода в рамках простых молекулярных орбиталей методов имеют мало смысла, т. к. приводят к методикам расчета, сравнимым по сложности с более точными методами квантовой химии.
Заключение
В настоящее время создана «целая отрасль науки - квантовая химия, занимающаяся приложением квантово-механических методов к химическим проблемам. Однако было бы принципиально ошибочным думать, что все вопросы строения и реакционной способность органических соединений могут быть сведены к задачам квантовой механики. Квантовая механика изучает законы движения электронов и ядер, т. е. законы низшей формы движения, сравнительно с той, которую изучает химия (движение атомов и молекул), а высшая форма движения никогда не может быть сведена к низшей. Даже для весьма простых молекул такие вопросы, как реакционная способность веществ, механизм и кинетика их превращений, не могут быть изучены только методами квантовой механики. Основой изучения химической формы движения материи являются химические методы исследования, и ведущая роль в развитии химии принадлежит теории химического строения.
Курсовая
В этом приближенном методе расчета состояние молекулы описывается так называемой волновой функцией ш, которая составляется по определенному правилу из ряда слагаемых: Сумма этих слагаемых должна учитывать все возможные комбинации, возникающие в результате попарного связывания атомов углерода за счет р-электронов. Часто приведенные валентные схемы изображают с учетом у-связей, например для бензола...
Методы исследования строения молекул (реферат, курсовая, диплом, контрольная)
1. Эксперементальные методы
1.1 Рентгеноэлектронная спектроскопия
1.2 Ифракрасная спектроскопия
1.3 Дифракционные методы
2. Теоретические методы
2.1 Полуэмпирические методы
2.2 Неэмпирические методы
2.3 Кванто-механические методы
2.4 Метод Хюккеля Заключение Список использованных источников
В современной органической химии большое значение имеют различные физические методы исследования. Их можно разделить на две группы. К первой группе относятся методы, позволяющие получать различные сведения о строении и физических свойствах вещества, не производя в нем никаких химических изменений. Из методов этой группы, пожалуй, наибольшее применение получила спектроскопия в широком диапазоне областей спектра -- от не слишком жестких рентгеновских лучей до радиоволн не очень большой длины. Ко второй группе относятся методы, в которых используются физические воздействия, вызывающие химические изменения в молекулах. В последние годы к ранее применявшимся широкоизвестным физическим средствам воздействия на реакционную способность молекулы прибавились и новые. Среди них особое значение имеют воздействия жестких рентгеновских лучей и потоков частиц больших энергий, получаемых в атомных реактора
Целью данной курсовой работы является — узнать о методах исследований строения молекул.
Задача курсовой работы:
Выяснить виды методов и изучить их.
1. ЭКСПЕРЕМЕНТАЛЬНЫЕ МЕТОДЫ
1.1 Р ентгеноэлектронная спектроскопия
Метод исследования электронного строения химического соединения, состава и структуры поверхности твердых тел, основанный на фотоэффекте с использованием рентгеновского излучения. При облучении вещества происходит поглощение рентгеновского кванта hv (h-постоянная Планка, v-частота излучения), сопровождающееся эмиссией электрона (наз. фотоэлектроном) с внутренних или внешних оболочек атома. Энергия связи электрона Е св в образце в соответствии с законом сохранения энергии определяется уравнением: Е св = hv-E кин, где E кин -кинетическая энергия фотоэлектрона. Значения Е св электронов внутренних оболочек специфичны для данного атома, поэтому по ним однозначно можно определить состав хим. соединения. Кроме того, эти величины отражают характер взаимодействия исследуемого атома с другими атомами в соединении, т. е. зависят от характера химической связи. Количеств состав образца определяют по интенсивности I потока фотоэлектронов. Принципиальная схема прибора для РЭС-электронного спектрометра-показана на рисунке 1. Образцы облучают рентгеновским излучением из рейтгеновской трубки либо синхротронным излучением. Фотоэлектроны попадают в анализатор-прибор, в котором из общего потока выделяются электроны с определенной Е кин. Сфокусировать монохроматический поток электронов из анализатора направляется в детектор, где определяется его интенсивность I. В рентгеноэлектронном спектре разным атомам соответствуют свои максимумы интенсивности (рисунок 2), хотя некоторые максимумы могут сливаться, давая одну полосу с увеличенной интенсивностью. Линии спектра обозначают следующим образом: рядом с символом элемента называют исследуемую орбиталь (напр., запись Cls означает, что регистрируют фотоэлектроны с орбитали 1s углерода).
Рисуник 1- Схема электронного спектрометра: 1-источник излучения; 2-образец; 3- анализатор; 4-детектор; 5-экран для защиты от магнитного поля Рисунок 2- Рентгеноэлектронный спектр Сls этилтрифторацетата РЭС позволяет исследовать все элементы, кроме Н, при содержании их в образце ~ 10 -5 г (пределы обнаружения элемента с помощью РЭС 10 -7 -10 -9 г). Относительное содержание элемента может составлять доли процента. Образцы могут быть твердыми, жидкими или газообразными. Величина E св электрона внутренней оболочки атома, А в химических соединениях зависит от эффективного заряда q А на этом атоме и электростатического потенциала U, создаваемого всеми другими атомами соединения: E св = kq А + U, где k-коэффициент пропорциональности.
Для удобства в РЭС вводят понятие химического сдвига E св, равного разности между Е св в исследуемом соединении и некотором стандарте. В качестве стандарта обычно используют значение E св, полученное для кристаллической модификации элемента; например, стандартом при исследовании соединении S служит кристаллическая сера. Поскольку для простого вещества q А 0 и U = 0, то E св = kq A + U. Таким образом, химический сдвиг свидетельствует о положительном эффективном заряде на изучаемом атоме, А в химическом соединении, а отрицательный об отрицательном заряде, причем значения E св пропорционально эффективному заряду на атоме. Поскольку изменение эффективного заряда на атоме, А зависит от его степени окисления, характера соседних атомов и геометрической структуры соединения, по E св можно определять природу функциональных групп, степень окисления атома, способ координации лигандов и т. д. Энергии связи электронов функциональных атомных групп слабо зависят от типа химического соединения, в котором находится данная функциональная группа.
1.2 И нфракрасная спектроскопия
Раздел оптической спектроскопии, изучающий спектры поглощения и отражения электромагнитного излучения в ИК области, т. е. в диапазоне длин волн от 10 -6 до 10 -3 м. В координатах интенсивность поглощенного излучения — длина волны (или волновое число) ИК спектр представляет собой сложную кривую с большим числом максимумов и минимумов. Полосы поглощения появляются в результате переходов между колебательными уровнями основного электронного состояния изучаемой системы. Спектральные характеристики (положения максимумов полос, их полуширина, интенсивность) индивидуальной молекулы зависят от масс составляющих ее атомов, геометрического строения, особенностей межатомных сил, распределения заряда и др. Поэтому И К спектры отличаются большой индивидуальностью, что и определяет их ценность при идентификации и изучении строения соединений. Для регистрации спектров используют классические спектрофотометры и фурье спектрометры. Основные части классического спектрофотометра — источник непрерывного теплового излучения, монохроматор, неселективный приемник излучения. Кювета с веществом (в любом агрегатном состоянии) помещается перед входной (иногда за выходной) щелью. В качестве диспергирующего устройства монохроматора применяют призмы из различных материалов (LiF, NaCl, KCl, CsF и др.) и дифракционной решетки. Последовательное выведение излучения различных длин волн на выходную щель и приемник излучения (сканирование) осуществляется поворотом призмы или решетки. Источники излучения — накаливаемые электрическим током стержни из различных материалов. Приемники: чувствительные термопары, металлические и полупроводниковые термосопротивления (болометры) и газовые термопреобразователи, нагрев стенки сосуда которых приводит к нагреву газа и изменению его давления, которое фиксируется. Выходной сигнал имеет вид обычной спектральной кривой. Достоинства приборов классической схемы: простота конструкции, относит дешевизна. Недостатки: невозможность регистрации слабых сигналов из-за малого отношения сигнал: шум, что сильно затрудняет работу в далекой ИК области; сравнительно невысокая разрешающая способность (до 0.1 см -1), длительная (в течение минут) регистрация спектров. В фурье-спектрометрах отсутствуют входная и выходная щели, а основной элемент — интерферометр. Поток излучения от источника делится на два луча, которые проходят через образец и интерферируют. Разность хода лучей варьируется подвижным зеркалом, отражающим один из пучков. Первоначальный сигнал зависит от энергии источника излучения и от поглощения образца и имеет вид суммы большого числа гармонических составляющих. Для получения спектра в обычной форме производится соответствующее фурье-преобразование с помощью встроенной ЭВМ. Достоинства фурье-спектрометра: высокое отношение сигнал: шум, возможность работы в широком диапазоне длин волн без смены диспергирующего элемента, быстрая (за секунды и доли секунд) регистрация спектра, высокая разрешающая способность (до 0.001 см -1). Недостатки: сложность изготовления и высокая стоимость. Все спектрофотометры снабжаются ЭВМ, которые производят первичную обработку спектров: накопление сигналов, отделение их от шумов, вычитание фона и спектра сравнения (спектра растворителя), изменение масштаба записи, вычисление экспериментально спектральных параметров, сравнение спектров с заданными, дифференцирование спектров и др. Кюветы для ИК спектрофотометров изготовляют из прозрачных в ИК области материалов. В качестве растворителей используют обычно ССl 4 , СНСl 3 , тетрахлорэтилен, вазелиновое масло. Твердые образцы часто измельчают, смешивают с порошком КВr и прессуют таблетки. Для работы с агрессивными жидкостями и газами применяют специально защитные напыления (Ge, Si) на окна кювет. Мешающее влияние воздуха устраняют вакуумированием прибора или продувкой его азотом. В случае слабо поглощающих в-в (разреженные газы и др.) применяют многоходовые кюветы, в которых длина оптические пути достигает сотен метров благодаря многократным отражениям от системы параллельных зеркал. Большое распространение получил метод матричной изоляции, при котором исследуемый газ смешивают с аргоном, а затем смесь замораживают. В результате полуширина полос поглощения резко уменьшается и спектр получается более контрастным. Применение специльной микроскопической техники позволяет работать с объектами очень малых размеров (доли мм). Для регистрации спектров поверхности твердых тел применяют метод нарушенного полного внутреннего отражения. Он основан на поглощении поверхностным слоем вещества энергии электромагнитного излучения, выходящего из призмы полного внутреннего отражения, которая находится в оптическом контакте с изучаемой поверхностью. Инфракрасную спектроскопию широко применяют для анализа смесей и идентификация чистых веществ. Количественный анализ основан на законе Бугера-Ламберта-Бера, т. е. на зависимости интенсивности полос поглощения от концентрации вещества в пробе. При этом о кол-ве вещества судят не по отделенным полосам поглощения, а по спектральным кривым в целом в широком диапазоне длин волн. Если число компонентов невелико (4−5), то удается математически выделить их спектры даже при значительном перекрывании последних. Погрешность количественного анализа, как правило, составляет доли процента. Идентификация чистых веществ производится обычно с помощью информационно-поисковых систем путем автоматического сравнения анализируемого спектра со спектрами, хранящимися в памяти ЭВМ. Для идентификации новых веществ (молекулы которых могут содержать до 100 атомов) применяют системы искусственного интеллекта. В этих системах на основе спектроструктурных корреляций генерируются молярные структуры, затем строятся их теоретические спектры, которые сравниваются с экспериментальными данными. Исследование строения молекул и др. объектов методами инфракрасной спектроскопии подразумевает получение сведений о параметрах моделей и математически сводится к решению т. наз. обратных спектральных задач. Решение таких задач осуществляется последовательным приближением искомых параметров, рассчитанных с помощью спец. теории спектральных кривых к экспериментальным. Параметрами мол. моделей служат массы составляющих систему атомов, длины связей, валентные и торсионные углы, характеристики потенциальной поверхности (силовые постоянные и др.), дипольные моменты связей и их производные по длинам связей и др. Инфракрасная спектроскопия позволяет идентифицировать пространственные и конформационные изомеры, изучать внутри- и межмолекулярные взаимодействия, характер химических связей, распределение зарядов в молекулах, фазовые превращения, кинетику химических реакций, регистрировать короткоживущие (время жизни до 10 -6 с) частицы, уточнять отдельные геом. параметры, получать данные для вычисления термодинамических функций и др. Необходимый этап таких исследований — интерпретация спектров, т. е. установление формы нормальных колебаний, распределения колебательной энергии по степеням свободы, выделение значимых параметров, определяющих положение полос в спектрах и их интенсивности. Расчеты спектров молекул, содержащих до 100 атомов, в т. ч. полимеров, выполняются с помощью ЭВМ. При этом необходимо знать характеристики мол. моделей (силовые постоянные, электрооптические параметры и др.), которые находят решением соответствующих обратных спектральных задач или квантовохимическими расчетами. И в том, и в другом случае обычно удается получать данные для молекул, содержащих атомы лишь первых четырех периодов периодической системы. Поэтому инфракрасная спектроскопия как метод изучения строения молекул получил наиболее распространение в органической и элементоорганической химии. В отдельных случаях для газов в ИК области удается наблюдать вращательную структуру колебательных полос. Это позволяет рассчитывать дипольные моменты и геом. параметры молекул, уточнять силовые постоянные и т. д.
1.3 Дифракционные методы
Дифракционные методы исследования структуры вещества, основаны на изучении углового распределения интенсивности рассеяния исследуемым веществом излучении рентгеновского (в т. ч. синхротронного), потока электронов или нейтронов. Различают рентгенографию, электронографию, нейтронографию. Во всех случаях первичный, чаще всего монохроматический, пучок направляют на исследуемый объект и анализируют картину рассеяния. Рассеянное излучение регистрируется фотографически или с помощью счетчиков. Поскольку длина волны излучения составляет обычно не более 0.2 нм, т. е. соизмерима с расстояниями между атомами в веществе (0.1−0.4 нм), то рассеяние падающей волны представляет собой дифракцию на атомах. По дифракционной картине можно в принципе восстановить атомную структуру вещества. Теория, описывающая связь картины упругого рассеяния с пространств, расположением рассеивающих центров, для всех излучений одинакова. Однако, поскольку взаимодействия разного рода излучений с веществом имеет разную физ. природу, конкретный вид и особенности дифракционной. картины определяются разными характеристиками атомов. Поэтому различные дифракционные методы дают сведения, дополняющие друг друга.
Основы теории дифракции. Плоскую монохроматическую. волну с длиной волны и волновым вектором, где можно рассматривать как пучок частиц с импульсом, где Амплитуда волны, рассеянной совокупностью из атомов, определяется уравнением:
По такой же формуле рассчитывают и атомный фактор, при этом описывает распределение рассеивающей плотности внутри атома. Значения атомного фактора специфичны для каждого вида излучения. Рентгеновские лучи рассеиваются электронными оболочками атомов. Соответствующий атомный фактор численно равен числу электронов в атоме, если выражен в названии электронных единицах, т. е. в относительных единицах амплитуды рассеяния рентгеновского излучения одним свободном электроне. Рассеяние электронов определяется электростатическим потенциалом атома. Атомный фактор для электрона связан соотношением:
исследование молекула спектроскопия дифракционный квантовый Рисунок 2- Зависимость абсолютных значений атомных факторов рентгеновских лучей (1), электронов (2) и нейтронов (3) от угла рассеяния Рисунок 3- Относительная зависимость усредненных по углу атомных факторов рентгеновских лучей (сплошная линия), электронов (штриховая)и нейтронов от атомного номера Z
При точных расчетах рассматривают отклонения распределения электронной плотности или потенциала атомов от сферической симметрии и название атомно-температурный фактор, учитывающий влияние тепловых колебаний атомов на рассеяние. Для излучения помимо рассеяния на электронных оболочках атомов существует роль может играть резонансное рассеяние на ядрах. Фактор рассеяния f м зависит от волновых векторов и векторов поляризации падающей и рассеянной волн. Интенсивность I (s) рассеяния объектом пропорциональна квадрату модуля амплитуды: I (s)~|F (s)| 2 . Экспериментально можно определить лишь модули |F (s)|, а для построения функции рассеивающей плотности ® необходимо знать также фазы (s) для каждого s. Тем не менее теория дифракционных методов позволяет по измеренным I (s) получить функцию ®, т. е. определить структуру веществ. При этом лучшие результаты получают при исследовании кристаллов. Структурный анализ. Монокристалл представляет собой строго упорядоченную систему, поэтому при дифракции образуются лишь дискретные рассеянные пучки, для которых вектор рассеяния равен вектору обратной решетки.
Для построения функции (х, у, z) по экспериментально определяемым величинам применяют метод проб и ошибок, построение и анализ функции межатомных расстояний, метод изоморфных замещений, прямые методы определения фаз. Обработка экспериментальных данных на ЭВМ позволяет восстанавливать структуру в виде карт распределения рассеивающей плотности. Структуры кристаллов изучают с помощью рентгеновского структурного анализа. Этим методом определено более 100 тысяч структур кристаллов.
Для неорганических кристаллов с применением различных методов уточнения (учет поправок на поглощение, анизотропию атомно-температурного фактора и т. д.) удается восстановить функцию с разрешением до 0.05
Рисунок 4- Проекция ядерной плотности кристаллической структуры Это позволяет определять анизотерапию тепловых колебаний атомов, особенности распределения электронов, обусловленные химической связью, и т. д. С помощью рентгеноструктурного анализа удается расшифровывать атомные структуры кристаллов белков, молекулы которых содержат тысячи атомов. Дифракция рентгеновских лучей используется также для изучения дефектов в кристаллах (в рентгеновской топографии), исследования приповерхностных слоев (в рентгеновской спектрометрии), качественного и количественного определения фазового состава поликристаллических материалов. Электронография как метод изучения структуры кристаллов имеет след. особенности: 1) взаимодействие вещества с электронами намного сильнее, чем с рентгеновскими лучами, поэтому дифракция происходит в тонких слоях вещества толщиной 1 -100 нм; 2) f э зависит от атомного ядра слабее, чем f р, что позволяет проще определять положение легких атомов в присутствии тяжелых; Структурная электронография широко применяется для исследования тонкодисперсных объектов, а также для изучения разного рода текстур (глинистые минералы, пленки полупроводников и т. п.). Дифракция электронов низких энергий (10 -300 эВ, 0.1−0.4 нм) — эффективный метод исследования поверхностей кристаллов: расположения атомов, характера их тепловых колебаний и т. д. Электронная микроскопия восстанавливает изображение объекта по дифракционной картине и позволяет изучать структуру кристаллов с разрешением 0.2−0.5 нм. Источниками нейтронов для структурного анализа служат ядерные реакторы на быстрых нейтронах, а также импульсные реакторы. Спектр пучка нейтронов, выходящих из канала реактора, непрерывен вследствие максвелловского распределения нейтронов по скоростям (его максимум при 100 °C соответствует длине волны 0.13 нм).
Монохроматизацию пучка осуществляют разными способами — с помощью кристаллов-монохроматоров и др. Нейтронографию используется, как правило, для уточнения и дополнения рентгеноструктурных данных. Отсутствие монотонной зависимости f и от атомного номера позволяет достаточно точно определять положение легких атомов. Кроме того, изотопы одного в того же элемента могут иметь сильно различающиеся значения f и (так, f и углеводорода 3.74.10 13 см, у дейтерия 6.67.10 13 см). Это дает возможность изучать расположение изотопов и получать дополнит. сведения о структуре путем изотопного замещения. Исследование магнитного взаимодействия. нейтронов с магнитнами моментами атомов дает информацию о спинах магнитного атомов. Мёссбауэровское -излучение отличается чрезвычайно малой шириной линии — 10 8 эВ (тогда как ширина линии характеристических излучения рентгеновских трубок. 1 эВ). Это обусловливает высокую временную и пространств. согласованность резонансного ядерного рассеяния, что позволяет, в частности, изучать магнитное поле и градиент электрического поля на ядрах. Ограничения метода — слабая мощность мёссбауэровских источников и обязательное присутствие в исследуемом кристалле ядер, для которых наблюдается эффект Мёссбауэра. Структурный анализ некристаллических веществ. Отдельные молекулы в газах, жидкостях и твердых аморфных телах по-разному ориентированы в пространстве, поэтому определить фазы рассеянных волн, как правило, невозможно. В этих случаях интенсивность рассеяния обычно представляют с помощью т. наз. межатомных векторов r jk , которые соединяют пары различных атомов (j и k) в молекулах: r jk = r j — r k . Картина рассеяния усредняется по всем ориентациям:
2 ТЕОРЕТИЧЕСКИЕ МЕТОДЫ
2.1 Полуэмпирические методы
Полуэмпирические методы квантовой химии, методы расчета мол. характеристик или свойств вещества с привлечением экспериментальных данных. По своей сути полуэмпирические методы аналогичны неэмпирическим методам решения уравнения Шрёдингера для многоатомных систем, однако для облегчения расчетов в полуэмпирических методах вводятся дополнит. упрощения. Как правило, эти упрощения связаны с валентным приближением, т. е. основаны на описании лишь валентных электронов, а также с пренебрежением определенными классами молекулярных интегралов в точных уравнениях того неэмпирического метода, в рамках которого проводится полуэмпирический расчет.
Выбор эмпирических параметров основан на обобщении опыта неэмпирических расчетов, учете химических представлений о строении молекул и феноменологических закономерностей. В частности, эти параметры необходимы для аппроксимации влияния внутренних электронов на валентные, для задания эффективных потенциалов, создаваемых электронами остова, и т. п. Использование экспериментальных данных для калибровки эмпирических параметров позволяет устранить ошибки, обусловленные упомянутыми выше упрощениями, однако лишь для тех классов молекул, представители которых служат опорными молекулами, и лишь для тех свойств, по которым параметры определялись.
Наиболее распространены полуэмпирические методы, основанные на представлениях о мол. орбиталях (см. Молекулярных орбиталей методы, Орбиталь). В сочетании с ЛКАО-приближением это позволяет выразить гамильтониан молекулы через интегралы на атомных орбиталях. При построении полуэмпирических методов в мол. интегралах выделяют произведения орбиталей, зависящих от координат одного и того же электрона (дифференциальное перекрывание), и пренебрегают некоторыми классами интегралов. Напр., если нулевыми считаются все интегралы, содержащие дифференциальное перекрывание cаcb при а. b, получается т. наз. метод полного пренебрежения дифференциала. перекрыванием (ППДП, в англ. транскрипции CNDO-complete neglect of differential overlap). Применяют также частичное или модифицированное частичное пренебрежение дифференциальное перекрыванием (соотв. ЧПДП или МЧПДП, в английской транскрипции INDO- intermediate neglect of differential overlap и MINDO-modified INDO), пренебрежение двухатомным дифференциальное перекрыванием — ПДДП, или neglect of diatomic differential overlap (NDDO), — модифицирование пренебрежение двухатомным перекрыванием (МПДП, или modified neglect of diatomic overlap, MNDO). Как правило, каждый из полуэмпирических методов имеет несколько вариантов, которые принято указывать в названии метода цифрой или буквой после косой черты. Напр., методы ППДП/2, МЧПДП/3, МПДП/2 параметризованы для расчетов равновесной конфигурации ядер молекулы в основном электронном состоянии, распределения заряда, потенциалов ионизации, энтальпий образования химических соединений, метод ЧПДП используется для расчета спиновых плотностей. Для расчета энергий электронного возбуждения применяют спектроскопическую параметризацию (метод ППДП/С). Распространено также использование в названиях полуэмпирических методов соответствующих программ для ЭВМ. Напр., один из расширенных вариантов метода МПДП называют Остинской моделью, как и соответствующую программу (Austin model, AM). Имеется несколько сотен различных вариантов полуэмпирических методов, в частности разработаны полуэмпирические методы, аналогичные конфигурационного взаимодействия методу. При внешних схожести разных вариантов полуэмпирических методов каждый из них можно применять для расчета лишь тех свойств, по которым проведена калибровка эмпирических параметров. В наиб. простых Полуэмпирических расчетах каждая мол. орбиталь для валентных электронов определяется как решение одноэлектронного уравнения Шрёдингера с оператором Гамильтона, содержащим модельный потенциал (псевдопотенциал) для электрона, находящегося в поле ядер и усредненном поле всех остальных электронов системы. Такой потенциал задают непосредственно с помощью элементарных функций или основанных на них интегральных операторов. В сочетании с ЛКАО-приближением подобный подход позволяет для многих сопряженных и ароматического мол. систем ограничиться анализом p-электронов (см. Хюккеля метод), для координационной соединений-пользоваться расчетными методами поля лигандов теории и кристаллического поля теории и т. п. При изучении макромолекул, напр. белков, или кристаллических образований нередко пользуются полуэмпирическими методами, в которых электронное строение не анализируется, а определяется непосредственно поверхность потенциальной энергии. Энергию системы приближенно считают суммой парных потенциалов взаимодействия атомов, напр. потенциалов Морса (Морзе) или Леннард-Джонса (см. Меж молекулярные взаимодействия). Такие полуэмпирические методы позволяют проводить расчет равновесной геометрии, конформационных эффектов, энергии изомеризации и т. п. Нередко парные потенциалы дополняют определенными для отдельных фрагментов молекулы многочастичными поправками. Полуэмпирические методы такого типа, как правило, относят к молекулярной механике. В более широком смысле к полуэмпирическим методам относятся любые методы, в которых определенные решением обратных задач параметры мол. системы используются для предсказаний новых экспериментальных данных, построения корреляционных соотношений. В этом смысле полуэмпирическими методами являются методы оценки реакционной способности, эффективных зарядов на атомах и т. п. Сочетание полуэмпирического расчета электронного строения с корреляц. соотношениями позволяет оценивать биологическую активность различных веществ, скорости химических реакций, параметры технологических процессов. К полуэмпирическим методам относятся и некоторые аддитивные схемы, напр. применяемые в химической термодинамике методы оценки энергии образования как суммы вкладов отдельных фрагментов молекулы. Интенсивное развитие полуэмпирических методов и неэмпирических методов квантовой химии делает их важными средствами современные исследования механизмов хим. превращений, динамики элементарного акта хим. реакции, моделирования биохимических и технологических процессов. При правильном использовании (с учетом принципов построения и способов калибровки параметров) полуэмпирические методы позволяют получить надежную информацию о строении и свойствах молекул, их превращениях.
2.2Неэмпирические методы
Принципиально иное направление расчетной квантовой химии, сыгравшее огромную роль в современном развитии химии в целом, состоит в полном или частичном отказе от вычисления одноэлектронных (3.18) и двухэлектронных (3.19)-(3.20) интегралов, фигурирующих в методе ХФ. Вместо точного оператора Фока используется приближенный, элементы которого получают эмпирическим путем. Параметры оператора Фока подбирают для каждого атома (иногда с учетом конкретного окружения) или для пар атомов: они либо являются фиксированными, либо зависят от расстояния между атомами. При этом часто (но не обязательно — см. ниже) предполагается, что многоэлектронная волновая функция является однодетерминантной, базис — минимальным, а атомные орбитали Х; - симметричными ортогональными комбинациями ОСТ Хг Такие комбинации легко получить, аппроксимируя исходные АО функциями Слейтера "Xj (2.41) с помощью преобразования Полуэмпирические методы работают гораздо быстрее, чем неэмпирические. Они применимы к большим (часто — к очень большим, например, биологическим) системам и для некоторых классов соединений дают более точные результаты. Однако следует понимать, что это достигается за счет специально подобранных параметров, справедливых лишь в пределах узкого класса соединений. При переносе на другие соединения те же методы могут дать абсолютно неверные результаты. Кроме того, параметры часто подбираются таким образом, чтобы воспроизводить только определенные молекулярные свойства, поэтому придавать физический смысл отдельным параметрам, используемым в схеме расчета, не следует. Перечислим основные приближения, используемые в полуэмпирических методах.
1. Рассматриваются только валентные электроны. Считают, что электроны, относящиеся к атомным остовам, лишь экранируют ядра. Поэтому влияние этих электронов учитывают, рассматривая взаимодействие валентных электронов с атомными остовами, а не с ядрами, и вводя энергию отталкивания остовов вместо энергии межъядерного отталкивания. Поляризацией остовов пренебрегают.
2. В МО учитывают только АО с главным квантовым числом, соответствующим высшим заселенным электронами орбиталям изолированных атомов (минимальный базис). Предполагают, что базисные функции образуют набор ортанормированных атомных орбиталей- ОСТ, ортогонализованных по Лёвдину.
3. Для двухэлектронных кулоновских и обменных интегралов вводят приближение нулевого дифференциального перекрывания (НДП) .
Молекулярной структуре в пределах структурной области может соответствовать набор модификаций молекулы, сохраняющих одинаковую систему валентных химических связей при разной пространствеиной организации ядер. В этом случае глубокий минимум ППЭ дополнительно имеет несколько неглубоких (эквивалентных или неэквивалентных по энергии) минимумов, разделенных небольшими потенциальными барьерами. Различные пространствеиные формы молекулы, преобразующиеся друг в друга в пределах данной структурной области путем непрерывного изменения координат атомов и функциональных групп без разрыва или образования химических связей, составляют множество конформаций молекулы. Набор конформаций, энергии которых меньше намнизшего барьера, примыкающего к данной структурной области ППЭ, называется конформационным изомером, или конформером. Конформеры, соответствующие локальным минимумам ППЭ, называются устойчивыми или стабильными. Таким образом, молекулярную структуру можно определить как совокупность конформаций молекулы в определенной структурной области Часто встречающимся в молекулах типом конформационного перехода является вращение отдельных групп атомов относительно связей: говорят, что имеет место внутреннее вращение, а различные конформеры называют вращательными изомерами, или ротамерами. При вращении меняется и электронная энергия, причем ее значение в процессе такого движения может проходить через максимум; в этом случае говорят о барьере внутреннего вращения. Последние во многом обусловлены способностью этих молекул легко адаптировать структуру при взаимодействии с разными системами. Каждому энергетическому минимуму ППЭ соответствует пара энантиомеров с одинаковой энергией — правый ® и левый (S). Эти пары имеют энергии, отличающиеся всего на 3.8 ккал/моль, однако они разделены барьером высотой 25.9 ккалjмоль и, следовательно, весьма устойчивы при отсутствии внешних воздействий. Результаты квантово-химических расчетов энергий барьеров внутреннего вращения для некоторых молекул и соответствующие экспериментальные значения. Теоретические и экспериментальные величины барьеров вращения для связей С-С, С-Р, C-S отличаются всего на 0.1 ккал/моль; для связей С-0, C-N, C-Si, несмотря на использование базисного набора с включением поляризационных функций (см. ниже), разница заметно выше. 1"ем не менее, можно констатировать удовлетворительную точность расчета энергий барьеров внутреннего вращения методом ХФ.
Подобные расчеты энергий барьеров внутреннего вращения для простых молекул помимо спектроскопических приложений важны как критерий качества того или иного расчетного метода. Большого внимания заслуживает внутреннее вращение в сложных молекулярных системах, например, в полипептидах и белках, где этот эффект обусловливает мноmе биологически важные функции этих соединений. Вычисление поверхностей потенциальной энергии для таких объектов представляет собой сложную задачу как в теоретическом, так и в практическом плане. Распространенным видом конформационного перехода является инверсия, такая, какая имеет место в пирамидальных молекулах типа АХ3 (А= N, Si, Р, As, Sb; Х =Н, Li, F и др.). В этих молекулах атом, А может занимать позиции как выше, так и ниже плоскости, образованной тремя атомами Х. Например, в молекуле аммиака NH3 метод ХФ дает величину энергетического барьера, равную 23,4 ккал/моль; это неплохо согласуется с экспериментальным значением барьера инверсии — 24.3 ккал/моль. Если барьеры между минимумами ППЭ сопоставимы с тепловой энергией молекулы, это приводит к эффекту структурной нежесткости молекулы; конформационные переходы в таких молекулах происходят постоянно. Для решения уравнений ХФ применяется метод самосогласованного поля. В процессе решения оптимизируются только орбитали, занятые электронами, следовательно, энергии лишь этих орбиталей находят физически обоснованно. Однако метод. ХФ дает и характеристики свободных орбиталей: такие молекулярные спин-орбитали называются виртуальными. К сожалению, они описывают возбужденные энергетические уровни молекулы с погрешностью около 100%, и применять их для трактовки спектроскопических данных следует с осторожностью — для этого существуют другие методы. Также как и для атомов, метод ХФ для молекул имеет различные версии, в зависимости от того, является ли однодетерминантная волновая функция собственной функцией оператора квадрата полного спина системы S2 или нет. Если волновая функция построена из пространствеиных орбиталей, занятых парой электронов с противоположными спинами (молекулы с замкнутыми оболочками), это условие выполняется, а метод называется ограниченным методом Хартри-Фока (ОХФ). Если требование быть собственной функцией оператора на волновую функцию не накладывается, то каждая молекулярная спин-орбиталь отвечает определенному спиновому состоянию (а или 13), то есть электроны с противоположными спинами занимают разные спин-орбитали. Такой метод обычно применяется для молекул с открытыми оболочками и называется неограниченным методом ХФ (НХФ), или методом разных орбиталей для разных спинов. Иногда низколежащие энергетические состояния описывают орбиталями, дважды занятыми электронами, а валентные состояния описывают однократно занятыми молекулярными спин-орбиталями; этот метод назьmается ограниченным методом Хартри-Фока для открытых оболочек (ОХФ- 00). Как и в атомах волновая функция молекул с открытыми оболочками не соответствует чистому спиновому состоянию, и могут возникать решения, у которых симметрия волновой функции по спину понижена. Они называются НХФ-нестабильными решениями.
2.3 Квантово-механические методы
Успехи теоретической химии, развитие квантовой механики создали возможность приближенных количественных расчетов молекул. Известно два важнейших метода расчета: метод электронных пар, называемый также методом валентных связей, и метод молекулярных орбит. Первый из этих методов, разработанный Гейтлером и Лондоном для молекулы водорода, приобрел широкое распространение в 30-х годах нынешнего столетия. В последние годы все большее значение приобретает метод молекулярных орбит (Гунд, Э. Хюккель, Мулликен, Герц-берг, Ленард-Джонс).
В этом приближенном методе расчета состояние молекулы описывается так называемой волновой функцией ш, которая составляется по определенному правилу из ряда слагаемых:
Сумма этих слагаемых должна учитывать все возможные комбинации, возникающие в результате попарного связывания атомов углерода за счет р-электронов.
Для того чтобы облегчить расчет волновой функции ш, отдельные слагаемые (C1ш1, C2ш2 и т. д.) условно изображаются графически в виде соответствующих валентных схем, которые используются как вспомогательные средства при математическом расчете. Например, когда указанным способом рассчитывают молекулу бензола и принимают во внимание только р-элек-троны, то таких слагаемых получается пять. Этим слагаемым соответствуют следующие валентные схемы:
Часто приведенные валентные схемы изображают с учетом у-связей, например для бензола Такие валентные схемы называют «невозмущенными структурами» или «предельными структурами»
Функции ш1, ш2, ш3 и т. д. различных предельных структур входят в волновую функцию ш с тем большими коэффициентами (с тем большим весом), чем меньше энергия, рассчитанная для соответствующей структуры. Электронное состояние, соответствующее волновой функции ш, наиболее устойчиво сравнительно с электронными состояниями, изображаемыми функциями ш1, ш2, ш3 и т. д. ; энергия же состояния, изображаемого функцией ш (реальной молекулы), естественно, является наименьшей сравнительно с энергиями предельных структур.
При расчете молекулы бензола по методу электронных пар учитываются пять предельных структур (I--V). Две из них тождественны классической структурной формуле Кекуле и три--формуле Дьюара. Так как энергия электронных состояний, соответствующих предельным структурам III, IV и V, выше, чем для структур I и II, то вклад структур III, IV и V в смешанную волновую функцию молекулы бензола шменьше, чем вклад структур I и II. Поэтому в первом приближении для изображения распределения электронной плотности в молекуле бензола достаточно двух эквивалентных структур Кекуле .
Около тридцати лет назад Л. Полинг развил качественные эмпирические представления, имеющие некоторые аналогии с методом электронных пар; эти представления были им названы теорией резонанса. Согласно основному постулату этой теории, любая молекула, для которой можно написать несколько классических структурных формул, не может быть правильно изображена ни одной из этих отдельно взятых формул (предельных структур), а только их набором. Качественная картина распределения электронной плотности в реальной молекуле описывается суперпозицией предельных структур (каждая из которых представлена с определенным весом).
Предельные структуры не соответствуют каким-либо реальным электронным состояниям в невозбужденных молекулах, однако не исключено, что они могут осуществляться в возбужденном состоянии или в момент реакции.
Вышеизложенная качественная сторона теории резонанса совпадает с концепцией мезомерии, несколько ранее развитой Инголдом и независимо от него Арндтом.
Согласно этой концепции, истинное состояние молекулы является промежуточным («мезомерным») между состояниями, изображенными двумя или несколькими «предельными структурами», которые можно написать для данной молекулы, пользуясь правилами валентности.
Кроме этого основного положения теории мезомерии, к ее аппарату относятся хорошо разработанные представления об электронных смещениях, в обосновании, интерпретации и опытной проверке которых важная роль принадлежит Инголду. Согласно Инголду, механизмы электронных смещений (электронных эффектов) различны в зависимости от того, осуществляется ли взаимное влияние атомов через цепь простых или сопряженных двойных связей. В первом случае это -- индукционный эффект I (или также статический индукционный эффект Is), во втором случае -- мезомерный эффект М (статический эффект сопряжения).
В реагирующей молекуле электронное облако может поляризоваться по индукционному механизму; такое электронное смещение называется индуктомерным эффектом Id. В молекулах с сопряженными двойными связями (и в ароматических молекулах) поляризуемость электронного облака в момент реакции обусловлена электромерным эффектом E (динамический эффект сопряжения).
Теория резонанса не вызывает никаких принципиальных возражений, пока речь идет о способах изображения молекул, но она имеет и большие претензии. Аналогично тому, как в методе электронных, пар волновая функция описывается линейной комбинацией других волновых функций ш1, ш2, ш3 и т. д. , теория резонанса предлагает описывать истинную волновую функцию шмолекулы в виде линейной комбинации волновых функций предельных структур.
Однако математика не дает критериев для выбора тех или иных «резонансных структур»: ведь в методе электронных пар волновую функцию можно представить не только как линейную комбинацию волновых функций ш1, ш2, ш3 и т. д. , но и как линейную комбинацию любых других функций, подобранных с определенными коэффициентами. Выбор же предельных структур может быть сделан только на основе химических соображений и аналогий, т. е. здесь концепция резонанса по существу не дает ничего нового по сравнению с концепцией мезомерии.
При описании распределения электронной плотности в молекулах с помощью предельных структур необходимо постоянно иметь в виду, что отдельно взятые предельные структуры не соответствуют какому-либо реальному физическому состоянию и что никакого физического явления «электронного резонанса» не существует.
Из литературы известны многочисленные случаи, когда сторонники концепции резонанса приписывали резонансу смысл физического явления и считали, что за определенные свойства веществ ответственны те или иные отдельные предельные структуры. Возможность возникновения таких ошибочных представлений заложена во многих пунктах концепции резонанса. Так, когда говорят о «различных вкладах предельных структур» в реальное состояние молекулы, легко может возникнуть представление о реальном существовании этих соотношений. Реальная молекула в концепции резонанса считается «резонансным гибридом»; этот термин может навести на мысль о якобы реальном взаимодействии предельных структур, подобно гибридизации атомных орбит.
Неудачен также термин «стабилизация за счет резонанса», так как стабилизация молекулы не может быть обусловлена несуществующим резонансом, а представляет собой физическое явление делокализации электронной плотности, характерное для сопряженных систем. Целесообразно поэтому это явление называть стабилизацией за счет сопряжения. Энергия сопряжения (энергия делокализации, или энергия мезомерии) может быть определена экспериментальным путем, независимо от «энергии резонанса», вытекающей из квантово-механических расчетов. Это -- разность между энергией, вычисленной для гипотетической молекулы с формулой, соответствующей одной из предельных структур, и энергией, найденной экспериментально для реальной молекулы.
С указанными выше оговорками способ описания распределения электронной плотности в молекулах с помощью нескольких предельных структур несомненно может быть использован наряду с двумя другими также весьма распространенными способами.
2.4 Метод Хюккеля
Хюккеля метод, квантовохимический метод приближенного расчета энергетических уровней и мол. орбиталей ненасыщенных орг. соединений. Основан на предположении, согласно которому движение электрона вблизи атомного ядра в молекуле не зависит от состояний или числа др. электронов. Это позволяет максимально упростить задачу определения мол. орбиталей (МО) в представлении линейной комбинацией атомных орбиталей. Метод предложен Э. Хюккелем в 1931 для расчета электронного строения углеводородов с сопряженными связями. Считается, что атомы углерода сопряженной системы лежат в одной плоскости, относительно которой высшие занятые и низшие виртуальные (свободные) МО (граничные мол. орбитали) антисимметричны, т. е. являются орбиталями, образованными атомными 2рz-орбиталями (АО) соответствующих атомов С. Влиянием остальных атомов, напр. Н, или мол. фрагментов с насыщенными связями пренебрегают. Предполагается, что каждый из М атомов углерода сопряженной системы вносит в систему один электрон и описывается одной атомной 2рz-орбиталью (k = 1, 2, …, М). Простая модель электронного строения молекулы, даваемая Хюккеля методом, позволяет понять многие хим. явления. Например неполярность альтернантных углеводородов обусловлена тем, что эффективные заряды на всех атомах углерода равны нулю. Напротив, неальтернантная конденсированная система 5- и 7-членного циклов (азулен) имеет дипольный момент ок. 1Д (3.3×10 -30 Кл x м). В нечетных альтернантных углеводородах основное энергетическое. состояние отвечает электронной системе, в которой есть хотя бы одна однократно занятая орбиталь. Можно показать, что энергия этой орбитали та же, что и в свободном атоме, в связи с чем она наз. несвязывающей МО. Удаление или добавление электрона изменяет заселенность лишь несвязывающей орбитали, что влечет появление заряда на некоторых атомах, который пропорционален квадрату соответствующего коэффициент в разложении несвязывающей МО по АО. Для определения такой МО применяют простое правило: сумма коэффициент Ck для всех атомов, соседних с любым данным, должна быть равна нулю. Кроме того, значения коэффициент должны отвечать дополнит. условию нормировки: Это приводит к характерному чередованию (альтернированию) зарядов на атомах в мол. ионах альтернантных углеводородов. В частности, указанное правило объясняет выделение по хим. свойствам орто- и пара-положений в бензольном ядре по сравнению с мета-положением. Закономерности, установленные в рамках простого Хюккеля метода, искажаются при более полном учете всех взаимодействие в молекуле. Однако обычно влияние множества разнородных дополнит, факторов (например электронов остова, заместителей, межэлектронного отталкивания и т. п.) качественно не меняет орбитальную картину электронного распределения. Поэтому Хюккеля метод часто используют для моделирования сложных механизмов реакций с участием орг. соединений. При введении в молекулу гетероатомов (N, О, S, …) существенными становятся параметры матрицы H, принимаемые для гетероатома и для атомов углерода. В отличие от случая полиенов, разные типы атомов или связей описываются разными параметрами или и их соотношение существенно влияет на вид МО; качество предсказаний, получаемых в рамках простого Хюккеля метода, как правило, в итоге ухудшается. Простой по своей идее, наглядный и не требующий сложных вычислений Хюккеля метод является одним из наиболее распространенных средств создания квантовохимической модели электронного строения сложных мол. систем. Наиб. эффективно его применение в тех случаях, когда свойства молекулы определяются в основные топологические структурой хим. связей, в частности симметрией молекулы. Попытки построить улучшенные варианты Хюккеля метода в рамках простых молекулярных орбиталей методов имеют мало смысла, т. к. приводят к методикам расчета, сравнимым по сложности с более точными методами квантовой химии.
Заключение
В настоящее время создана «целая отрасль науки -- квантовая химия, занимающаяся приложением квантово-механических методов к химическим проблемам. Однако было бы принципиально ошибочным думать, что все вопросы строения и реакционной способность органических соединений могут быть сведены к задачам квантовой механики. Квантовая механика изучает законы движения электронов и ядер, т. е. законы низшей формы движения, сравнительно с той, которую изучает химия (движение атомов и молекул), а высшая форма движения никогда не может быть сведена к низшей. Даже для весьма простых молекул такие вопросы, как реакционная способность веществ, механизм и кинетика их превращений, не могут быть изучены только методами квантовой механики. Основой изучения химической формы движения материи являются химические методы исследования, и ведущая роль в развитии химии принадлежит теории химического строения.
Список использованных источников
1. Минкин, В. И. Теория строения молекул/ В. И. Минкин. -М.:Высш.шк., 2006- 640с.
2. Вилков, Л. В. Физические методы исследования в химии./ Л. В. Вилков, Ю. А. Пентин. — М.:Высш.шк., 2005−380с.
3. Гардымова, А. П. Научная электронная библиотека: элементы и устройства вычислительной техники и систем управления / А. П. Гардымова. — 2005.
4. Ельяшевич, М. А. Атомная и молекулярная спектроскопия/ М. А. Ельяшевич, В. Демтредер. -М.: Мир, 1989−260с.
5. Блатов, В. А. Полуэмпирические расчетные методы/ В. А. Блатов, А. П. Шевченко. — М.: «Универс- групп» 2005−315с.
6. Цирельсон, В. Г. Квантовая химия, молекулы, молекулярные системы и твердые тела -М.: «БИНОМ» 2010−496с.
Учреждение образования «Брестский государственный университет имени А.С. Пушкина»
Кафедра химии
КУРСОВАЯ
РАБОТА
Методы
исследования органических соединений
Выполнила:
студентка 5 курса,
биологического
факультета
специальности
«Биология. Химия»
очной формы
обучения
Петручик
Ирина Александровна
Научный руководитель:
Боричевский
Александр Иванович
Брест, 2012
Методы исследования органических
соединений
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ………………………………………………………… …………..
3
-
Классификация методов исследования органических веществ………. 4
Простейшие методы исследования органических веществ
2.1.1 Кристаллизация………………………………………… ……… 6
2.1.2 Возгонка………………………………………………………… . 7
2.1.3 Перегонка……………………………………………………… .. 8
2.1.4 Хроматография…………………………………………… …. 9-11
2.2 Анализ органических веществ………………………………….. 12-13
-
Физико-химические методы исследования органических веществ… 14
3.2 Калориметрия……………………………………………… ……… 17
3.3 Рентгенография и электронография…………………………… 18-19
3.4 Электрохимические методы исследования…………………… 20-21
3.5 Спектроскопия…………………………………………… …….. 22-27
ЗАКЛЮЧЕНИЕ…………………………………………………… ……….…. 28
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ…………………………. 29
ВВЕДЕНИЕ
Изучение органических веществ
преследует цель установления строения
вещества, его пространственной структуры
и характеристических молекулярных орбиталей,
изучение взаимодействия атомов и молекул,
исследование скоростей и механизмов
реакции. Ввиду огромного числа разнообразных
органических соединений нельзя выработать
единую схему анализа, как часто делается
в неорганическом количественном анализе.
И все же систематическое исследование
позволяет достаточно надежно и быстро
идентифицировать органическое вещество.
Установление строения органического
вещества – это главная цель их изучения
вне зависимости от метода исследования.
Однако интересы, связанные с исследованием
того или иного органического соединения,
уже имеют разный характер. Особенную
важность имеют вопросы, касающиеся природных
ресурсов нашей планеты. Мы знаем, что
особенное значение для человечества
имеют источники нефти и газа, но они ограничены.
Поэтому назрела проблема поисков нового
сырья для органического и нефтехимического
синтеза, получения нефти и газа искусственным
путем. Но это лишь одна из причин изучения
органических веществ. Если посмотреть
вокруг, то все живое на Земле это органическая
химия. Соответственно, изучение органических
веществ это ключ к глобальным открытиям
в области живой природы, возможность
узнать все жизненноважные процессы, найти
пути излечения многих страшных заболеваний,
создавать самим живые материи и т.д.
-
Классификация методов изучения органических веществ.
- простейшие методы изучения: очистка органических веществ (кристаллизация, возгонка, перегонка, хроматография, гель-фильтрация, электрофорез) и анализ органических веществ (количественный и качественные элементные анализы);
- физико-химические методы: рефрактометрия, калориметрия, измерение электрических дипольных моментов, рентгенография и электронография, электрохимические методы (полярография, анодная вольтамперометрия), спектроскопия (фотоэлектронная, масс-спектроскопия, инфракрасная и т.д.)
Простейшие методы исследования органических веществ
-
Очистка органических веществ
Для характеристики чистоты вещества используют следующие константы и методы: температура плавления, температура кристаллизации, температура кипения, коэффициент преломления света, плотность, данные спектров поглощения (коэффициент интенсивности поглощения в электронных и инфракрасных спектрах), данные спектров ядерного магнитного резонанса (ЯМР), масс-спектрометрии, хроматографический анализ, люминесцентный анализ и др.
Получить чистое вещество – означает разделить данную смесь веществ на индивидуальные вещества, очистить до желаемой степени чистоты. Здесь необходимо различать две совокупности методов: методы разделения смеси на компоненты, которые еще не являются чистыми, и методы конечной очистки.
Говоря о чистоте химических веществ, нужно отдавать себе отчет в том, что абсолютно чисто вещество можно представить только теоретически. Абсолютно чистых веществ нет и быть не может. В зависимости от методы очистки вещество содержит определенное количество примесей. Обычными методами очистки можно достичь содержания основного вещества 99,9…99,95%. Специальными методами глубокой очистки можно уменьшить содержание примесей для органических веществ до 10 -3 ….10 -4 %
2.1.1 Кристаллизация
Кристаллизация
является классическим методом очистки
кристаллических веществ. Метод
основан на том, что разные вещества
имеют разную растворимость в определенном растворителе,
причем понижение температуры (за редким
исключением) приводит к уменьшению растворимости
веществ. Фильтрованием горячего раствора
отделяют нерастворимые примести, и после
охлаждения вещество выделяется из раствора
в виде кристаллов. Повторные перекристаллизации
обычно уменьшают количество примесей.
Вариантом метода является кристаллизация
из расплава. Специальный вариант – зонная
плавка – применяется для глубокой очистки
веществ.
Например: нам необходимо очистить салициловую
кислоту от примесей. Для этого мы берем
взвешенную предварительно массу этой
кислоты и рассчитываем необходимый обьем
растворителя – воды, для того, чтобы получить
насыщенный раствор, который впоследствии
можно будет кристаллизировать.
2.1.2 Возгонка (Сублимация)
Многим кристаллическим
веществам свойственна способность
к возгонке, т.е. к переходу в газовую
фазу, минуя жидкую, с последующей
кристаллизацией из газовой фазы.
Этот метод позволяет отделить сублимирующиеся
вещества от несублимирующихся примесей и разделить смесь веществ
с разными температурами сублимации или
температурами кристаллизации из газовой
фазы (градиентная возгонка). Если вещества
возгоняются трудно и при высоких температурах
разлагаются, применяют возгонку в вакууме
или высоком вакууме – до 0,0013 Па (10 -5
мм рт.ст.; 1 мм рт.ст.=133,3 Па). Высоковакуумная
возгонка в различных вариантах применяется
для глубокой очистки.
Очистка твердого вещества
возгонкой возможна только в том
случае, если давление его паров
выше, чем давление паров примесей.
Когда давление паров твердого вещества
соответствует приложенному давлению
получают наилучшие результаты.
Например: Е-стильбен возгоняют при температуре
100 о С и давлении 20 мм рт. ст.
2.1.3 Перегонка
(дистилляция)
Для многих низкоплавких веществ и большинства жидкостей
хорошим методом очистки является
Фракционная перегонка при
условии, что разница в температурах
кипения компонентов смеси достаточно
велика и не образуются азеотропные
смеси. Селективность (эффективность)
фракционной перегонки можно увеличить
специальными приспособлениями: дефлегматорами,
дистилляционными колоннами и др. Для
высококипящих веществ применяется вакуумная
перегонка. Вариантом метода является
перегонка двухкомпонентных систем, которые
при охлаждении расслаиваются, например
перегонка с водным паром: лимонен (т.кип. 178 о С при
760 мм рт. ст.) перегоняется с водой (т.кип.
100 о С при 760 мм рт. ст.) при температуре
98 о С. При этом количественное соотношение
в дистилляте (в граммах) лимонен: вода
составляет 1: 1,54.
2.1.4 Хроматография
Методы хроматографического
разделения основываются на различной
способности веществ адсорбироваться
на поверхности сорбента или распределяться
между двумя несмешивающимися фазами
(жидкость-жидкость, жидкость-газ), из которых одна фаза (жидкая) находится
на поверхности сорбента. Поэтому различают
разные виды хроматографии, а именно: жидкостную
адсорбционную и распределительную хроматографию,
газовую хроматографию.
Жидкостная адсорбционная хроматография основана на различной способности
веществ сорбироваться на поверхности
сорбента и десорбироваться при пропускании
растворителя – элюента. В Качестве сорбентов
применяют оксид алюминия, кремниевую
кислоту и диоксид кремния (силикагели),
гранулированные полисахариды (декстраны)
или другие полимеры, которые в растворителе
набухают, образуя гранулированный гель
(гель-хроматография).
Жидкостная
распределительная хроматография является разновидностью адсорбционной
хроматографии, в которой сорбент (носитель)
покрыт тонкой пленкой какой-то жидкости.
Элюентом обычно является растворитель,
который не смешивается с жидкостью на
сорбенте. При пропускании элюента происходит
распределение веществ между жидкой фазой
и элюентом. Этот вид хроматографии наиболее
пригоден для разделения веществ, хорошо
растворимых в воде или способных образовывать
растворимые в воде соли. К таким веществам
относятся сахар, аминокислоты, многие
органические красители, большая часть
алкалоидов, моно- и поликарбоновые кислоты,
спирты и т. д.
Пример жидкостной
хроматографии смеси стандартов синтетических
фосфолипидов (1) и образца грубого липддного
экстракта из клеточной мембраны эритроцитов
человека(2) на нормально фазной колонке
при детектировании лазерным светорассеивающим
детектором.НЛ – нейтральные липиды; ФЭ
– фосфатидилэтаноламин; ФС – фосфатидилсерин;
ФХ – фосфатидилхолин; СМ – сфингомиелин.
Газовая
хроматография применяется для разделения
смесей газообразных или легкоиспаряемых
жидких и твердых веществ. Принцип метода
подобен жидкостной хроматографии. Разделяемую
смесь разбавляют газом-носителем (H 2,
N 2 , He) и вводят в адсорбционные колонны.
Газ-носитель является одновременно растворителем
и элюентом. В качестве сорбентов используют
тонкие порошки силикатных материалов,
которые могут быть чистыми (газо-адсорбционная
хроматография) или покрытыми пленкой
нелетучей жидкости (газо-жидкостная хроматография).
Используют также капилляры, покрытые
внутри пленкой нелетучей жидкости (капиллярная
хромотография). Газ-носитель постепенно
десорбирует компоненты смеси и уносит
с собой. Присутствие органических веществ
в газе-носителе и их количество обнаруживается
при помощи специальных детекторов и фиксируется
самописцем. В препаративной хроматографии
газ-носитель затем пропускают через специальные
приемники, в которых органические вещества
улавливают вымораживанием.
Этим методом
можно достичь полного разделения
смеси. При использовании адсорбционных
колонн повышенной мощности метод применяется
как препаративный для разделения
небольших количеств веществ (1….10
г).
Пример
газовой хроматографии: скоростной анализ паров взрывчатых
веществ на поликапиллярной колонке при
температуре 170°С.
Поликапиллярная колонка длиной всего
22 см позволяет за 2.5 минуты обнаружить
и идентифицировать следовые количества
паров взрывчатых веществ: 1 - 2,6-динитротолуол,
2 - 2.4-динитротолуол. 3 - 2,4,6-тринитротолуол,
4 - 3,4,5-трининитротолуол, 5 - 2.3,4-тринитротолуол,
6 - гексоген. 7 - тетрил.
-
Анализ органических веществ
Первой задачей является качественное и количественное определение элементного состава. Затем по данным элементного анализа вычисляют простейшую суммарную формулу, определяют молекулярную массу и вычисляют истинную молекулярную брутто-формулу. И наконец, заключительным этапом является определение молекулярной структуры. Для этой цели используют химические методы (постепенное расщепление, получение производных), а в последнее время все чаще применяют физико-химические методы (масс-спектроскопия, рентгеноструктурный анализ, спектроскопия).
Количественный и качественный элементный анализ
В основе методов анализа лежит полное расщепление органического вещества в результате окисления или другим путем и определение химических элементов известными методами. Углерод определяют в виде СО 2, водород – в виде H 2 О, азот – измерением объема N 2 или определением NH 3 или NaCN (в зависимости от вида расщепления), галогены – в виду галогенид-ионов, серу – в виде сульфат- или сульфид-иона, фосфор в виду фосфат-иона и т.д.
Качественно углерод и водород определяют при нагревании с CuO:
C n H 2n +3nCuO>nCO 2 +nH 2 O+3nCu
И выделяющийся оксиду углерода обнаруживают пропусканием газа в раствор Ba(OH) 2 , а воду обнаруживают визуально на стенках пробирки.
Азот, серу и галогены качественно определяют при сплавлении натрием. Образующиеся NaCN, Na 2 S и галогениды натрия обнаруживают в водном растворе обычными аналитическими реакциями.
Для количественного анализа органических соединений существуют специальные пробы. Раньше обычно применялись установки для макроанализа (навеска образца 0,2 … 0,5 г). В наши дни распространены различные приборы для микроанализа (навеска 0,001…0,01 г), для ультрамикроанализа (навеска 10 -5 ...10 -4 г). Для количественного определения углерода и водорода используют приборы, в которых органическое вещество сжигают в токе кислорода: CO 2 улавливают раствором KOH, а H 2 O – специальным абсорбентом и определяют взвешиванием. Для количественного определения азота используют сожжение вещества при нагревании с CuO и объем выделившегося газа измеряют в азометре над раствором KOH. Галогены и серу количественно определяют сожжением образца в атмосфере кислорода, растворением газов в воде и титрованием галогенид-ионов или сульфат-иона.
Разработаны автоматические микроанализаторы с использованием принципа газовой хроматографии, в которых одновременно определяют углерод, водород, азот и серу.
Молекулярную массу соединения обычно определяют масс-спектрометрически.
-
Физико-химические методы исследования органических веществ
-
Спектральные и другие оптические методы;
Электрохимические методы;
Хроматографические методы анализа.
Группа электрохимических методов анализа, основанная на измерении электрической проводимости, потенциалов и других свойств, включает методы кондуктометрии, потенциометрии, вольтамперометрии и т.д.
Но для того, чтобы точно убедиться в более лучшей эффективности этих методов и их действительном большом практическом значении, рассмотрим для сравнения и другие физико-химические методы.
-
Рефрактометрия
, где n – коэффициент преломления света для D-линии натрия (589нм); M – молекулярная масса вещества; ?? – плотность.
Молекулярная рефракция имеет аддитивные свойства, т.е. молекулярная рефракция молекулы может быть получена суммированием рефракций составных частей молекулы. Такими составными частями являются химические связи и совокупность связей и атомов. Эти рефракции вычислены на основе исследований многих органических соединений и могут быть найдены в справочниках. Например:
R CH4 = 4 R C-H ; R CH3NO2 = 3 R C-H +R C-N +R NO2
Явление преломления света связано с поляризуемостью электронной системы молекул. Под влиянием электромагнитного поля света происходит поляризация молекул, в основном их электронных систем. Чем подвижнее электронная система молекулы, тем больше коэффициент преломления света и молекулярная рефракция.
Исследования молекулярной рефракции могут быть использованы для установления структуры соединения. Так, для изучаемого соединения экспериментально определяют молекулярную рефракцию и сравнивают с рефракцией, полученной суммированием рефракций связей по предполагаемой структурной формуле. Если результаты совпадают, то можно считать структуру доказанной, если нет, то надо искать другую структуру. В некоторых случаях наблюдают сильное увеличение молекулярной рефракции по сравнению с ожидаемой (экзальтация рефракции). Это характерно для сопряженных систем.
Значения молекулярной рефракции химических связей, атомов, молекул и ионов могут быть использованы для качественной оценки их поляризуемости. Поляризуемостью молекулы (иона, связи) называют способность ее к поляризации, т.е. к изменению положения ядер и состояния электронного облака под влиянием внешнего электрического поля. В основном происходит электронная поляризация.
3.2 Калориметрия
Калориметрия
является методом исследования тепловых
эффектов химических реакций и процессов
фазовых переходов (например, плавления,
кристаллизации, возгонки, конденсации).
Процесс (реакцию) проводят в специальных
приборах – калориметрах и количественно
оценивают выделенное или поглощенное
тепло.
Калориметрическим
путем определяют молярные теплоты
сгорания веществ. В свою очередь
теплоты сгорания (W) используют для вычисления
теплоты образования вещества E или стандартной
энтальпии образования?H 0 . Теплота
образования вещества может быть вычислена,
исходя из элементов в атомарном состоянии
или из элементов в «стандартном» состоянии
(углерод в виду графита, газообразный
водород и т.д.), при этом полученные числовые
значения, естественно, отличаются. При
рассмотрении табличных данных на это
надо особенно обращать внимание. Обычно
теплоты образования веществ для процесса
вычисляются из атомов элементов, а?H 0
- из элементов в «стандартном» состоянии.
Например, теплота образования углеводородов
из атомов:
- nS -
] – W, где W – теплота сгорания;
- теплота образования CO 2
(393,5 кДж/моль);
- теплота образования воды
(285,8 кДж/моль); S – теплота атомизации (возгонки)
углерода (графита) (-715 кДж/моль);
- теплота атомизации (диссоциации)
молекулы водорода (-436 кДж/моль).
Чем меньше теплота
сгорания, тем больше теплота образования
соединений одинакового состава.
В основном этот
метод служит для сравнения и
характеристики стабильности и реакционной
способности органических соединений.
3.3 Рентгенография
и электронография
Рентгенографический
метод – рентгеноструктурный
анализ – основан на дифракции
рентгеновских лучей в кристалле
вещества. Рентгеновские лучи
(электромагнитное излучение с длиной
волны 0,1-10 нм) при прохождении через кристалл
взаимодействует с электронными оболочками
атомов. В результате этого взаимодействия
происходит дифракция рентгеновских лучей
и на фотопленке получается дифракционная
картина – пятна или окружности. Из дифракционной
картины при помощи сложных расчетов получают
сведения о размещении молекул в элементарной
ячейке кристалла и о расстояниях между
атомами и углах между химическими связями.
Чем меньше число электронов в атоме, тем
слабее рефлексы рентгеновских лучей.
Поэтому определить местонахождение атомов
водорода весьма трудно.
Электронографический
метод подобен рентгенографическому
и основан на взаимодействии потока
электронов с веществом. Поток электронов при прохождении через
вещество напоминает электромагнитное
излучение с очень небольшой длиной волны
и дает дифракционную картину. Эти дифракционные
картины (электронограммы) можно получить
для веществ в газообразном состоянии
или для очень тонких пленок. Дифракция
электронов обусловлена взаимодействием
электронов с атомными ядрами.
Эти методы структурного
анализа дают возможность определить
полную структуру молекулы – межатомные
расстояния, углы между связями, т.е.
точное пространственное расположение всех атомов молекулы в кристаллической
решетке или в газообразном состоянии.
Методом рентгеноструктурного анализа
определена структура таких сложных природных
веществ, как сахароза, пенициллин, стрихнин,
витамин B 12 , некоторые белки (миоглобин)
и нуклеиновые кислоты.
Из рентгенографических
методов исследования было установлено,
что ковалентный радиус атомов при sp 2 - и sp-гибридизации меняется
в зависимости от типа связи, например
в двойной связи С=С (С sp2 - С sp2)
ковалентный радиус атома углерода С sp2
меньше, чем в связи =С-С (С sp2 - С sp3).
В 1-ом случае он составляет 0,067 нм, во 2-ом
– 0,076 нм, а в случае бензола - 0,0695 нм, т.е.
длина связи также зависит уже от самого
соединения и у каждого соединения длины
связей являются уже индивидуальной характеристикой,
что может пригодиться при идентификации
определенного органического соединения.
3.4 Электрохимические
методы исследования
Электрохимические
методы основаны на зависимости силы
тока от приложенного напряжения при
прохождении тока через раствор в электролизерах
специальной конструкции. В результате
появляются кривые зависимости силы тока
– напряжение (потенциал). Эти вольтамперные
кривые характеризуют процессы, проходящие
на электродах. На каотед происходит электрохимическое
восстановление, а на аноде – электрохимическое
окисление. В зависимости от типа изучаемого
процесса (анодного или катодного) применяются
приборы, отличающиеся между собой соотношением
площадей электродов, материалом электродов
и др
Полярография
В основе полярографического метода лежат катодные
процессы (присоединение электрона к веществу
на ртутном капающем электроде). Принципиальная
схема полярографа очень проста. Он состоит
из капающего ртутного микроэлектрода
с непрерывно обновляющейся поверхностью
и электрода сравнения (ртутный или другой
нормальный электрод). Площадь катода
значительно меньше площади анода, поэтому
решающими в этом случае являются процессы
поляризации катода. Органическое вещество
диффундирует к катоду и принимает электрон,
происходит деполяризация катода. Деполяризация
катода начинается при определенном потенциале
Е выд (потенциал восстановления
или выделения, характерный для данного
деполяризатора. В результате начинается
электролиз и сила тока круто возрастает.
При постепенном увеличении напряжения
устанавливается некоторое стационарное
значение силы тока (предельный ток), которое
уже не зависит от повышения напряжения.
Полярографию
можно использовать для характеристики
процесса:
Метод полярографии
широко используется для определения
концентрации веществ в растворах.
Анодная
вольтамперометрия
В основе этого
метода лежат анодные процессы (окисление
органического соединения на платиновом
или графитовом аноде). С точки
зрения экспериментального осуществления
этот метод подобен полярографии.
Анодную вольтамперометрию используют
для изучения процессов окисления:
Метод используют также для количественных определений веществ в растворах.
3.5 Спектроскопия
В основе спектроскопических
методов лежит взаимодействие вещества
с электромагнитным излучением, что вызывает поглощение
излучения или его эмиссию. Взаимодействие
возможно в очень широком интервале электромагнитных
волн, начиная с?-лучей и кончая радиоволнами.
В зависимости
от области электромагнитного спектра
применяют различные эксперимен тальные методы и приборы.
В органической
химии наиболее часто используются
следующие области электромагнитного
излучения:
- ультрафиолетовая
(УФ) и видимая область спектра,
где поглощается энергия, необходимая
для возбуждения электронов в
молекуле (вид электронной спектроскопии);
- инфракрасная
(ИК) область, где поглощается
энергия, необходимая для изменения
колебательных состояний молекулы
(колебательная спектроскопия);
- область радиочастотного
излучения, где энергия затрачивается
для переориентации спинов ядер (спектроскопия
ядерного магнитного резонанса – ЯМР).
Спектральные
методы применяются с целью идентификации
и установления структуры соединений,
анализа смесей, а также позволяют
следить за ходом химических превращений.
Достоинством спектральных методов является малый расход
вещества (1 мг и менее).
Электронная
спектроскопия
Электронный спектр
возникает при поглощении веществом
ультрафиолетового (длины волн 22-400
нм) и видимого (400-800 нм) излучения. Принципиальной
разницы между этими участками спектра нет, они различаются
лишь тем, что волны длиной 400-800 нм воспринимаются
человеческим глазом, и мы видим вещество
окрашенным.
Под действием
УФ-света происходит возбуждение
молекулы, т.е. переход электронов на
более возбужденный уровень и
перераспределение электронной плотности
в молекуле. Труднее всего возбуждаются
электроны, образующие?-связи, легче –
электроны?-связей и неподеленные пары
электронов.
С середины 20 в. происходят коренные изменения в методах химических исследований, в которые вовлекается широкий арсенал средств физики и математики. Классические задачи химии - установление состава и строения веществ - всё успешнее решаются с использованием новейших физических методов. Неотъемлемой чертой теоретической и экспериментальной химии стало применение новейшей быстродействующей вычислительной техники для квантовохимических расчётов, выявления кинетических закономерностей, обработки спектроскопических данных, расчёта структуры и свойств сложных молекул.
Из числа чисто химических методов, разработанных в 20 в., следует отметить микрохимический анализ, позволяющий производить аналитические операции с количествами веществ, в сотни раз меньшими, чем в методе обычного химического анализа. Большое значение приобрела хроматография, служащая не только для аналитических целей, но и для разделения весьма близких по химическим свойствам веществ в лабораторных и промышленных масштабах. Важную роль играет физико-химический анализ (ФХА) как один из методов определения химического состава и характера взаимодействия компонентов в растворах, расплавах и др. системах. В ФХА широко используются графические методы (диаграммы состояния и диаграммы состав - свойство). Классификация последних позволила уточнить понятие химического индивида, состав которого может быть постоянным и переменным. Предсказанный Курнаковым класс нестехиометрических соединений приобрёл большое значение в материаловедении и новой области - химия твёрдого тела.
Люминесцентный анализ, метод меченых атомов, рентгеновский структурный анализ, электронография, полярография и др. физико-химические методы анализа находят широкое применение в аналитической химии Использование радиохимических методик позволяет обнаружить присутствие всего нескольких атомов радиоактивного изотопа (например, при синтезе трансурановых элементов).
Для установления строения химических соединений важное значение имеет молекулярная спектроскопия, с помощью которой определяются расстояния между атомами, симметрия, наличие функциональных групп и др. характеристики молекулы, а также изучается механизм химических реакций. Электронная энергетическая структура атомов и молекул, величина эффективных зарядов выясняются посредством эмиссионной и абсорбционной рентгеновской спектроскопии. Геометрия молекул исследуется методами рентгеновского структурного анализа.
Обнаружение взаимодействия между электронами и ядрами атомов (обусловливающего сверхтонкую структуру их спектров), а также между внешними и внутренними электронами позволило создать такие методы установления строения молекул, как ядерный магнитный резонанс (ЯМР), электронный парамагнитный резонанс (ЭПР), ядерный квадрупольный резонанс (ЯКР), гамма-резонансная спектроскопия. Особую роль по широте применения приобрела ЯМР-спектроскопия. Для выяснения пространственных характеристик молекул возрастающее значение приобретают оптические методы: спектрополяриметрия, круговой дихроизм, дисперсия оптического вращения. Разрушение молекул в вакууме под влиянием электронного удара с идентификацией осколков применяется для установления их строения методом масс-спектроскопии. Арсенал кинетических методов пополнился средствами, связанными с использованием ЭПР - и ЯМР-спектроскопии (химическая поляризация ядер), метода импульсного фотолиза и радиолиза. Это позволяет изучать сверхбыстрые процессы, протекающие за время 10-9 сек и меньше.
Роль и место физических методов исследования при изучении некоторых разделов химии высокомолекулярных соединений в школе и в вузе
Введение
Глава 1. Физические методы исследования в химии
1.1 Химические и физические свойства молекул и веществ
1.2 Классификация физических методов исследования в химии
1.2.1 Спектроскопические методы
1.2.2 Лазерная спектроскопия
1.2.3. Дифракционные методы
1.2.4 Оптические методы
1.2.5 Масс – спектрометрия и спектроскопия электронов
1.2.6 Спектроскопические интерференции
1.2.7 Диэлькометрия и магнетохимия
1.2.8 Интеграция различных физических методов
Глава 2. ФМИ в исследовании ВМС
2.1 Метод изучения релаксации напряжения
2.2 Метод определения динамических механических характеристик эластомеров
2.3 Измерение напряжения при деформации
2.4 Прочность и модуль упругости при изгибе
2.5 Испытания на прочность при ударе
2. 6 Световая (оптическая) микроскопия
2.7 Электронная микроскопия
2.8. Рентгеноструктурный анализ
2.9 Электронография
2.10 Исследование полимеров методом УФ-спектроскопии
2.11. Оптические испытания
2.12 Инфракрасная спектроскопия (FTIR)
Глава 3. Экспериментальная часть
3.1 Мои уроки
Урок 1. Тема урок. Понятие о высокомолекулярных соединениях
Урок 2. Тема. Синтетические волокна
Урок 3. Тема. Распознание пластмасс и химических волокон
3.1.1 Констатирующий срез знаний
3.2 Изложение материала в КБГУ
3.2.1 Вводное занятие по теме: «Полимеры»
3.2.2 Закрепление знаний материалам лекции
3.2.3 Завершающий контроль знаний по теме
3.3 Семинарское занятие. Решение задач
3.4 Контрольный срез знаний (1 рейтинговая точка) Тесты
Обсуждение результатов. Выводы
Литература
Введение
Актуальность работы состоит в том, что и в школьном и в ВУЗовском курсах химии очень велик процент теоретических знаний о структуре и свойствах высокомолекулярных соединений. И это имеет место притом, что физические методы исследования при их оптимальном использовании при изучении курса могли бы весьма существенно повысить эффективность преподавания и максимально приблизить знания студентов и школьников к реальной структуре изучаемых веществ. Физические методы исследования, включаемые в содержание курса химии ВМС, не только дают представления о методах их использования, но и значительно расширяют общий кругозор учащихся. Необходимость такого использования ФМИ вытекает еще и из междисциплинарной сущности проблемы изучения физики и химии высокомолекулярных соединений.
Гипотеза работы – мы предположили, что увеличение относительного вклада сведений о физических методах исследования в соответствующие разделы химии ВМС как в ВУЗе, так и школе позволит оптимизировать содержание и повысить качество учебно-воспитательной работы.
Цель работы – теоретический поиск и экспериментальные исследования роли и места физических методов исследования при изучении некоторых разделов химии высокомолекулярных соединений в школе и в ВУЗе.
Для достижения цели были поставлены следующие задачи:
1. Провести аналитический обзор литературных данных по современным физическим методам исследования полимеров.
2. Проанализировать методические материалы преподаваемой темы «Высокомолекулярные соединения».
3. Учитывая изучаемый материал разработать различные подходы к проведению занятий по данной теме в школьном и вузовском курсе.
4. Оценить эффективность разработанных методических подходов после проведения уроков по результатам итогового тестирования.
Объект исследования – учебно-воспитательный процесс, реализуемый в средней школе и на университета.
Предмет исследования - выбор соответствующих форм организации занятий, обеспечивающих использование ФМИ при изучении дисциплины «Химия высокомолекулярных соединений».
Новизна работы – впервые ставится задача увеличеия объема сведений о ФМИ в содержании курса «Химия высокомолекулярных соединеий» помимо специальной дисциплины «Физические методы исследования»
Практическая значимость - Работа проводилась в рамках цикла исследований, которые ведутся на кафедрах химии высокомолекулярных соединений и педагогики и психологии и сразу непосредственно внедрена в учебную дисциплину.
Глава 1. Физические методы исследования в химии
Важнейшей особенностью современной химии является использование новых физико-химических и физических методов исследования. Наряду с классическими характеристиками веществ такими, как элементный состав, плотность, температура плавления и кипения, показатель преломления, активно используются структурные методы (рентгеноструктурный анализ, электронография, нейтронография), спектроскопические методы в широком диапазоне длин волн электромагнитного излучения (к новым методам можно отнести радиоспектроскопию и лазерную спектроскопию). Важное значение в химии имеют масс-спектрометрия и другие методы.
1.1 Химические и физические свойства молекул и веществ
В основе определения химических свойств находится молекулярная и структурная формулы веществ и реакционная способность. Обобщение химического эксперимента позволило создать теорию химического строения. Эта теория существенно обогатила науку о веществах, которой пользуются во многих других отраслях знаний.
Многие из химических свойств прямо или косвенно связаны с физическими свойствами. Существуют справочники, в которых приводятся все эти разнообразные физические свойства. Эти свойства важны сами по себе как характеристики вещества и для изучения взаимозависимости самих этих свойств. Так, известно различие атомной структуры алмаза и графита, а также их механических свойств.
Важно отметить, что, к сожалению, теория химического строения дает качественную или в лучшем случае полуколичественную картину соединения атомов в молекуле. Физические величины имеют определенные числовые характеристики. Поэтому мы можем в плане определения химического строения говорить о соответствии или корреляции физических величин и характеристик химического строения.
Особое значение физические методы имеют для целей определения состава веществ, то есть для аналитической химии. Это особый раздел применения физических методов в химии. Часто трудно разделить исследования состава и полной идентификации вещества. В большей степени в статье рассматривают вопросы идентификации и особенностей химического строения веществ на основе физических методов. В силу особенностей физических взаимодействий с веществом нет единого метода, который позволял бы определять все или очень большое число физических величин. Можно говорить о специализации в использовании физических методов исследования.
1.2 Классификация физических методов исследования в химии
Классификация методов не может быть абсолютно строгой, поскольку не всегда удается выделить специфические свойства, определяемые данным методом. Но в целом, возможно, оценить наиболее важные характеристики методов исследования .
1.2.1 Спектроскопические методы
В большинстве этих методов измеряют зависимость интенсивности излучения I, прошедшего через вещество или рассеянное веществом, от частоты v, т.е.определяют функцию I(v).
Наибольшее распространение для идентификации веществ получили колебательные и электронные спектры, лазерная спектроскопия, а также спектры ядерного магнитного резонанса.
В колебательной спектроскопии важно иметь полный интервал частот от очень низких, характерных для крутильных колебаний, до высоких значений. Частоты колебательных спектров используются также для расчета силовых полей молекул, то есть для определения различного типа сил взаимодействия атомов в молекуле. Так называемые силовые постоянные для значительного числа групп атомов обладают свойством переносимости, то есть постоянством в рядах сходных по строению молекул.
Электронная спектроскопия является очень чувствительным и удобным методом для определения спектров поглощения, пропускания и отражения, изучения кинетики реакции, сопровождающихся спектральными изменениями. В обычных условиях спектры имеют диффузный характер, что ограничивает их применение веществами, имеющими хромофорные группы. Эти спектры позволяют устанавливать наличие тех или иных групп в молекуле, то есть осуществлять групповой анализ, изучать влияние заместителей на электронные спектры и строение молекул, исследовать таутомерию и другие превращения.
Метод ядерного магнитного резонанса (ЯМР) основан на взаимодействии внешнего магнитного поля с ядрами для которых спиновое квантовое число равно ½, а также для ряда ядер со спиновым квантовым числом, большим ½. Одни и те же ядра атомов в различных окружениях в молекуле показывают различные сигналы ЯМР. Отличие такого сигнала ЯМР от сигнала стандартного вещества позволяет определить так называемый химический сдвиг, который обусловлен химическим строением изучаемого вещества. В методиках ЯМР есть много возможностей определять химического вещества. В методах ЯМР есть много возможностей определять химическое строение веществ, конформации молекул, эффекты взаимного влияния, внутримолекулярные превращения и т.п.
1.2.2 Лазерная спектроскопия
Лазерная спектроскопия позволяет исследовать вещества на атомно-молекулярном уровне с высокой чувствительностью, избирательностью, спектральным и временным разрешением. В зависимости от типа взаимодействия света с исследуемым веществом, методы лазерной спектроскопии подразделяют на линейные, основанные на одноквантовом линейном взаимодействии и нелинейные, основанные на нелинейном одноквантовом или многоквантовом взаимодействии. В спектральных приборах используют лазеры с перестраиваемой частотой - от далекой ИК области до вакуумного УФ, что обеспечивает возбуждение почти любых квантовых переходов атомов и молекул. Перестраиваемые лазеры с узкой полосой излучения, в частности, инжекционные лазеры в ИК области и лазеры на красителях в видимой области (а в сочетании с нелинейным преобразованием частоты - в ближней УФ и ближней ИК областях) дают возможность измерять истинную форму спектра поглощения образца без какого-либо влияния спектрального инструмента. Использование перестраиваемых лазеров повышает чувствительность всех известных методов спектроскопии (абсорбционных, флуоресценции и т.д.) как для атомов, так и для молекул. На основе таких лазеров были разработаны принципиально новые высокочувствительные методы: внутрирезонаторной лазерной спектроскопии, когерентного антистоксова комбинационного рассеяния, резонансной фотоионизационной лазерной спектроскопии. Последний метод основан на резонансном возбуждении частицы импульсным лазерным излучением, частота которого точно настроена на частоту резонансного перехода, и последующей ионизации возбужденной частицы путем поглощения одного или нескольких фотонов из дополнительного лазерного импульса. При достаточной интенсивности лазерных импульсов эффективность резонансной фотоионизации близка к 100%, такова же эффективность регистрации иона электронным умножителем. Это обеспечивает высокую чувствительность метода и возможность детектирования следов элементов в образцах на уровне 10 -10 -10 -12 % в обычных экспериментах, а в специальных - на уровне одиночных частиц. Высокая интенсивность излучения позволяет осуществлять нелинейное взаимодействие света с атомами и молекулами, за счет чего значительная часть частиц переведена в возбужденное состояние, а также становятся вероятными запрещенные одноквантовые и многоквантовые резонансные переходы между уровнями атомов и молекул, ненаблюдаемые при слабой интенсивности света.
Применение лазеров в спектроскопии резко повысило возможность традиционных методов, кроме того, позволило создать методы, основанные на принципиально новых физических принципах. Чувствительность спектроскопических методов доведена до предельного уровня, ограниченного регистрацией единичных атомов и молекул. Методы лазерной спектроскопии используются в лазерной химии , лазерном разделении изотопов.
Голография (от греческого holos - весь, полный, grapho - пишу) - способ записи и восстановления волнового поля, основанный на регистрации интерференционной картины, которая образована волной, отраженной предметом, освещаемым источником света (предметная волна ), и когерентной с ней волной, идущей непосредственно от источника света (опорная волна). Зарегистрированная интерференционная картина называется голограммой .
Голограмма, освещенная опорной волной, создает такое же амплитудно-фазовое пространственное распределение волнового поля, которое создавала при записи предметная волна. Таким образом, голограмма, за счет дифракции опорной волны на записанной в ней интерференционной картине, преобразует опорную волну в копию предметной.

1.2.3 Дифракционные методы
В дифракционных методах используются волновые свойства излучения и потока частиц электронов и нейтронов. Волновые свойства рентгеновских лучей были открыты в 1912 году немецким физиком Лауэ. Он заложил основы рентгеноструктурного анализа. В 1927 году экспериментально подтверждено явление дифракции электронов. Позднее открыта дифракция нейтронов.
Наиболее широкое применение в химии нашли два метода:
1. Рентгеноструктурный анализ, который позволяет определять координаты атомов в трехмерном пространстве кристаллических веществ от простейших соединений типа NaCI до сложных белков.
2. Газовая электронография, с помощью которой определяют геометрию свободных молекул в газах, то есть молекул, не подверженных влиянию соседних молекул, как это имеет место в кристаллах .
1.2.4 Оптические методы
Суть метода основывается на взаимодействии вещества со средой, а в качестве среды имеют электромагнитные волны оптического диапазона. В результате взаимодействия происходит изменение свойств веществ, вступивших в реакцию.
Применяется два общих способа измерения:
1) На глаз
2) Инструментальный метод
При взаимодействии вещества с электромагнитными волнами можно зафиксировать следующие изменения:
Угол преломления, который обусловлен поляризацией молекул вещества
Поглощение света веществом
Электрическая проводимость, которая может меняться и т. д.
Диапазон э\м волн l=100 – 100`000 м
J = с / l [Гц] V = 1/ l [см -1 ]
Для оптических методов анализа присущи такие характеристики, как коэффициент преломления, оптическая плотность и т.д.

Весь спектр обладает различными свойствами.
Есть методы, основывающиеся на поглощении света веществом. Поглощать свет могут молекулы и ионы.
1) колориметрия
2) фотоколориметрия
3) спектрофотометрия (использует весь диапазон) получают спектр вещества
Также может поглощаться атомами вещества – атомноабсоркционный метод.
Вещества, находящиеся в состоянии плазмы (высокая t), могут сами излучать свет.
Атомно-эмиссионный спектральный анализ - практически самый распространенный экспрессный высокочувствительный метод идентификации и количественного определения малых содержаний элементов. Важным достоинством метода по сравнению с другими оптическими спектральными, а также многими химическими и физико-химическими методами анализа является возможность одновременного количественного определения большого числа элементов в широком интервале концентраций с приемлемой точностью при использовании малой массы пробы.
Достоинствами метода атомно-флуоресцентного анализа являются сравнительно низкий уровень фона, высокая селективность измерений, малые спектральные помехи, что позволяет детектировать слабые аналитические сигналы и соответственно очень малые абсолютные количества элементов. К недостаткам метода атомно-абсорбционной и в определенной мере атомно-флуоресцентной спектрометрии следует отнести затруднительность одновременного определения нескольких элементов.
С точки зрения возможности определения ультрамалых абсолютных содержаний элементов-примесей (#10-11-10-12 г) из оптических атомно-спектральных методов заслуживают особого внимания новые атомно-флуоресцентные и атомно-ионизационные методы с возбуждением и ионизацией атомов с помощью перестраиваемых лазеров на красителях, а также некоторые современные варианты оптических атомно-эмиссионного и атомно-абсорбционного методов анализа. В последнее время широкое распространение получил атомно-эмиссионный анализ с возбуждением спектров в высокостабильной индуктивно-связанной плазме (ИСП-АЭС). Современные анализаторы на основе этого метода обычно включают полихроматор с решеткой эшелле и приемники с зарядовой связью. Такая оптическая схема позволяет одновременно регистрировать все спектральные линии в ультрафиолетовом и видимом диапазонах. Программное обеспечение современных ИСП-АЭС-анализаторов способно автоматически рассчитывать концентрацию определяемых элементов по интенсивности их спектральных линий с коррекцией фона и возможных спектральных наложений. Соответственно такие анализаторы отличаются высокой точностью и продуктивностью.
Пламенная фотометрия основана на излучении (эмиссионный метод) световой энергии элементов в пламени.
При фотометрии пламени анализируемый раствор сжатым воздухом или кислородом в виде аэрозоля вводят в пламя газовой горелки. При наличии в растворе ионов легковозбуждаемых элементов пламя окрашивается вследствие характерных излучений, которые фиксируются фотоэлементом. Возникающий фототок измеряется чувствительным гальванометром.

Рис. 1. Схема эмиссионного пламенного фотометра:
1 - компрессор; 2 - стакан с анализируемым раствором; З - распылитель; 4 - вентиль, регулирующий подачу газа; 5 - манометр; б - промывалка; 7 - горелка; 8- вогнутое зеркало; 9 линза; 10 - светофильтр (монохрома тор); 11-фотоэлемент (фотоумножитель); 12 - усилитель; 13 - стрелочный гальванометр.
1.2.5 Масс–спектрометрия и спектроскопия электронов
Эта группа методов отличается от предыдущих тем, что в результате взаимодействия какого-либо падающего излучения или потока частиц. Так, в масс-спектрометрии падающим потоком может быть поток электронов, ультрафиолетовое излучение, поток заряженных атомов или молекул, то есть ионов, которые порождают потоки молекулярных ионов, получившихся в результате распада молекулярного иона.
Методом масс-спектрометрии определяют молекулярные массы, идентифицируют вещества, устанавливают химическое строение веществ, изучают теплоты испарения и реакции, механизмы химических реакций, измеряют потенциалы ионизации и энергии разрыва химических связей.
Масс-спектрометрия представляет собой метод исследования веществ, основанный на определении массы (точнее, величины т/г) и относительного количества ионов, образованных из молекул, подвергнутых ионизации. Приборы, позволяющие получить масс-спектры, называются масс-спектрометрами.
Каждый масс-спектрометр независимо от деталей конструкции состоит из следующих основных элементов:
1)системы введения вещества в прибор;
2)источника ионов, предназначенного для получения ионов из анализируемых веществ;
3) масс-анализатора, предназначенного для разделения ионов 2 по массам (вернее, по отношению массы к заряду - т/г);
4) детектора и регистрирующего устройства, предназначенного для регистрации количества образующихся ионов различной массы;
5) вакуумной системы, обеспечивающей необходимый вакуум в приборе.
Схематическое изображение устройства масс-спектрометра приведено на рис. 2. Прежде всего исследуемое вещество надо ионизировать. Наиболее распространенным методом ионизации в органической масс-спектрометрии является бомбардировка вещества электронами в газовой фазе. Система введения вещества в прибор необходима для перевода исследуемого соединения в газовую фазу и непрерывной подачи его с постоянной скоростью (так называемое мономолекулярное натекание) в источник ионов 1, где происходит ионизация. В источнике ионов в условиях глубокого вакуума (10-5-10-9 мм рт. ст.) электроны, эмитируемые раскаленным катодом 2, получают за счет ускорения между заряженными пластинами определенную энергию (обычно 70 эВ). Проходя через разреженный газ, эти электроны сталкиваются с молекулами исследуемого вещества. Как только энергия электронов окажется несколько выше потенциала ионизации3 (9-12 эВ), становится возможным процесс ионизации.

Рис 2. Схема устройства однофокусного масс-спектрометра:
1 – источник ионов; 2 – источник электронов - катод; 3- ускорительные пластины; 4 – масс – анализатор; 5 – магнит; 6 – щель; 7 – коллектор ионов; 8 – умножитель (усиление ионных токов); 9- компьютер
Например, при этой энергии процесс взаимодействия электрона с молекулой метана можно изобразить так:
СН 4 + е - → СН 4 + 2е -
Ион СН 4 масса которого с точностью до одного электрона равна молекулярной массе метана, называется молекулярным ионом (М +).
При энергиях бомбардирующих электронов порядка 30-100Эв происходит не только ионизация, но и разрыв химических связей в бомбардируемой молекуле с образованием положительно заряженных ионов и нейтральных осколков.
Совокупность всех процессов, приводящих к образованию ионов различного вида, называется диссоциативной ионизацией.
Таким образом, в результате диссоциативной ионизации в источнике ионов образуются положительные ионы с разной массой. Все эти ионы выталкиваются электрическим полем из камеры, формируются в пучок и, ускоряясь разностью потенциалов в 2-4кВ, вылетают в масс-анализатор 4, в котором тем или иным способом делятся на группы или пучки ионов так, что в каждой из круп содержатся только ионы одной и той же массы.
Изменяя напряженность магнитного поля H при постоянном ускоряющем напряжении U, можно последовательно подавать на коллектор регистрирующего устройства 7 ионы с той или иной массой. Таким образом осуществляется развертка спектра .
1.2.6 Спектроскопические интерференции
С момента начала использования индуктивно-связанной плазмы для элементного анализа, этот метод ионизации развился в самый успешный из всех используемых. В начале он использовался как метод возбуждения в сочетании с эмиссионной спектроскопией. В последние 15 лет он широко используется в качестве источника ионов для масс-спектрометрии. Определенные технические проблемы, связанные с отбором ионов из плазмы, были успешно решены и комбинация источника с индуктивно-связанной плазмой и масс-спектрометра начала широко распространяться.
В индуктивно-связанной плазме ионы генерируются при атмосферном давлении, в то время как масс-спектрометр работает при давлении меньше чем 10 -5 мБар. Между ИСП и МС используется интерфейс в виде "узкого горла", с помощью которого вытягиваются ионы из плазмы и осуществляется перепад давлений. В начале развития ИСП/МС в каечтве интерфейса просто использовалось вытянутое носиком отверстие диаметром всего 50-70 мкм, охлаждаемое водой. Проблема, связанная с такой конструкцией заключалась в том, что холодные пограничные слои впереди конуса способствовали генерации большого количества посторонних ионов. Эту проблему удалось преодолеть путем увеличения диаметра входного отверстия до 1 мм, что отодвигало пограничные слои и ионы напрямую входили в масс-спектрометр из плазмы. Эта методика известна как непрерывный отбор образца и, следовательно, конус называется конус образца.

Рис. 3. Упрощенная схема масс-спектрометра высокого разрешения с индуктивно-связанной плазмой:
1 - ИСП источник ионов; 2 - интерфейс с конусом образца и скимерным конусом; 3 - передающая и фокусирующая оптика; 4 - фокусировка пучка ионов и ускорение; 5 - входная щель; 6 - электромагнит; 7 - электростатический сектор; 8 - выходная щель; 9 - конверсионный динод; 10 - электронный умножитель
Спектроскопические интерференции вызываются атомными или молекулярными ионами, имеющими такую же номинальную массу, что и изотоп анализируемого элемента.
1.2.7 Диэлькометрия и магнетохимия
В зависимости от величин электрических дипольных моментов или магнитных характеристик веществ внешние электрическое и соответственно магнитное поля изменяют поведение вещества в этих полях по сравнению с поведением в отсутствие поля.
Измерения диэлектрической проницаемости позволяют определить величину электрического дипольного момента, который характеризует полярность молекул. Кроме того, величина является источником структурной информации при использовании аддитивных схем.
Магнетохимические исследования дают возможность оценивать по степени парамагнетизма число неспаренных электронов, в атомах вещества. Диамагнетики выталкиваются магнитным полем и степень этого выталкивания обусловлена электронным строением молекул и вещества. Особенно показательно различие молярных диамагнитных восприимчивостей, параллельных и перпендикулярных плоскости молекул бензола, нафталина и других ароматических углеводородов. Это доказывает существование электронных токов в плоскостях ароматических молекул.
1.2.8 Интеграция различных физических методов
Физические величины, получаемые разными физическими методами, дают не только более полное описание физического состояния веществ, но и более полное описание химического строения веществ. Так, если рентгеноструктурное исследование не позволило определить координаты легких атомов водорода, то метод ЯМР дополняет картину химического строения веществ.
Рентгенография и нейтронография дополняют друг друга тем, что в рентгеноструктурных исследованиях определяют полное распределение электронной плотности кристаллических веществ, а в нейтронографических исследованиях – положение ядер атомов таких веществ. При совместной обработке данных рентгенографии и нейтронографии находят распределение электронной плотности в химических связях. Этого достигают тем, что из полной электронной плотности атомов вещества вычитают электронную плотность атомных остовов, положение которых вычисляют из данных нейтронографии.
Более надежно и полно определяются геометрические параметры молекул вещества в газовой фазе, если используют одновременно данные газовой электронографии, микроволновой спектроскопии, колебательной спектроскопии и результаты квантово-химических расчетов. Только совместное использование данных перечисленных методов позволяет решить поставленную задачу.
Поляризуемость молекул в общем случае выражается тремя числами, которые характеризуют различную поляризуемость молекул в трех направлениях трехмерного пространства. Так, молекула хлорбензола имеет три так называемых главных значения для поляризуемости: наибольшие вдоль кольца и меньшие в перпендикулярном направлении. Однако для того, чтобы экспериментально определить эти значения, необходимо совместно обработать данные по измерениям показателя преломления, изучить эффект Керра, найти электрический дипольный момент.
В связи со столь сложными проблемами в использовании физических методов имеет место специализация ученных. Как и в медицине, являющиеся очень наглядным примером, специалисты работают в относительно узких областях, которые требуют очень глубоких знаний и экспериментальных навыков. Практически каждый из физических методов является областью специализации. Однако как физик, так и химик, должны иметь представление о возможностях различных методов. Химик должен правильно ставить задачу. Физик должен не только решать ее, но и знать, как его результаты сопоставлять с другими методами.
Следует отметить еще одно важное обстоятельство. В связи со сложностью и дороговизной оборудования и различными возможностями метода распространения и широта использования физических методов существенно неодинаковы. Наиболее широко используются методы колебательной спектроскопии, масс-спектроскопии, ультрафиолетовой спектроскопии и ядерного магнитного резонанса. К более огрначенным по использованию в химических исследованиях относятся методы микроволновой спектроскопии, ядерного гамма-резонанса, ядерного квадрупольного резонанса, газовой электронографии, фотоэлектронной спектроскопии и др.
В столь сложной ситуации помогает кооперация ученых, которая позволяет решать возникающие проблемы .
Глава 2. ФМИ в исследовании ВМС
В настоящее время общеизвестна возросшая роль полимерных материалов в различных отраслях практической деятельности человека. В связи с этим остается актуальной проблема изучения существующих и разработки новых оригинальных методов изучения структуры и свойств полимеров. Несмотря на обилие специальной литературы по вопросам изучения, например, физико-механических свойств полимеров, ощущается дефицит методических разработок для широкого спектра дисциплин и спецкурсов, предназначенных для изучения полимеров и пластмасс различного назначения.
Приводимый ниже материал предназначен для студентов химического отделения, специализирующихся по органической химии и химии и физике высокомолекулярных соединений, а также может быть полезен аспирантам, инженерам и научным работникам.
2.1 Метод изучения релаксации напряжения
Явление релаксации - это процесс перехода из неравновесного в равновесное состояние любой физико-химической системы в пределах одного и того же фазового (агрегатного) состояния. Скорость процесса релаксации зависит от молекулярной подвижности элементов структуры системы. Релаксационные процессы в полимерах следует рассматривать как макроскопическое проявление их молекулярной подвижности в широком интервале температур. Для релаксационных процессов характерно уменьшение скорости их протекания с течением времени. Понятие "релаксационные свойства" охватывает весь комплекс вопросов, связанных с зависимостью механического поведения резины от временного режима нагружения.
Растяжение является практически наиболее важным видом деформации, применяемым для оценки механических свойств полимера. В растянутом образце при условии неизменной деформации, е = const, наблюдаем процесс релаксации напряжения. Изучение релаксации напряжения позволяет получить сведения о процессах, характеризующихся большими временами (т > и 1 с). Результаты испытания, полученные этим методом, поддаются наиболее ясному физическому истолкованию и имеют непосредственное практическое приложение к резинам, работающим в статических условиях деформирования.
Для изучения релаксации напряжения используется прибор, показанный на рис. 4, в котором исследуемый образец 4 прикрепляется к неподвижному верхнему зажиму 3 и подвижному нижнему зажиму 5. Верхний зажим связан с измерительным устройством, состоящим из стальной пластины 2, закрепленной консольно, и индикатора часового типа 1. Растяжение образца и фиксирование заданной деформации осуществляется при помощи устройства 7, связанного с нижним зажимом.
При проведении эксперимента жесткая пружина 6, распрямляясь, задает нужную деформацию и фиксирует ее. Растянутый образец деформирует стальную пластину 2, по величине деформации которой можно вести отсчет напряжения.

Рис. 4. Принципиальная схема статического релаксометра
Деформация образца не остается строго постоянной: она немного увеличивается по мере того, как пружинящий элемент смещается при релаксации напряжения. Однако, если жесткость пружины гораздо больше, чем жесткость образца, то релаксация напряжения будет определять постоянство его деформации.
Термокамера имеет электрический обогрев. Температура в камере поддерживается с точностью ± 0,5° при помощи схемы, в которой включены ЛАТР, вольтметр для регулирования напряжения в зависимости от температуры и потенциометр КВШ-503 .
2.2 Метод определения динамических механических характеристик эластомеров
Среди разнообразных методов изучения полимеров одно из важных мест занимают методы, связанные с исследованием поведения полимеров в переменных механических полях. Эти методы позволяют изучать температурно-частотную зависимость действительной и мнимой частей комплексного модуля упругости или податливости, что дает ценную информацию о молекулярном движении в материале и не может быть получено другими методами.
На температурной зависимости коэффициента механических потерь ж при постоянной частоте обычно проявляются несколько максимумов, что свидетельствует о реализации в этих областях некоторых релаксационных механизмов. Так, например, в области перехода из стеклообразного в высокоэластическое состояние механические потери, характеризующие внутреннее трение в полимерах, проходят через максимум, и наблюдается резкое изменение динамического модуля упругости, связанное с движением сегментов полимерных цепей. Температурно-частотная область, в которой проявляется какой-либо релаксационный процесс, называется областью дисперсии, областью перехода или областью релаксации.
В полимерах реализуются несколько переходов, обусловленных различными релаксационными механизмами. Проявление этих переходов значительно лучше наблюдать при малых частотах действия внешних сил. Низкотемпературные переходы сдвигаются при повышении частоты в сторону высоких температур и могут перекрываться с другими областями дисперсии.
Часто используется метод вынужденных нерезонансных колебаний, достоинством которого является независимость частоты воздействия от температуры и свойств исследуемого материала.
Метод вынужденных нерезонансных колебаний может применяться для определения динамических величин материалов с большими потерями.
Для исследования динамических величин эластомеров в ряду других методик применяется основанная на использовании прибора ДИП (динамический испытатель полимеров) (рис. 6), состоящего из следующих основных частей: электромотора 1, редуктора 2, вибратора 3, системы для измерения усилия, приложенного к образцу и его деформации (4-7), устройства для крепления образцов (10, 11), термо- и криокамер 8, системы терморегулирования 9. Он позволяет изучать динамические механические свойства полимеров в широких темпера-турно-частотных диапазонах в режиме вынужденных нерезонансных колебаний . Блок-схема прибора ДИП показана на рис. 5.

Рис. 5. Блок-схема динамического релаксометра марки ДИП:
1 - электромотор; 2 - редуктор;
3 - вибратор; 4, 5 - тензодатчики;
6 - тензоусилитель; 7 - самописец;
8 - термокамера;
9 - терморегулирующий блок;
10 - образец; 11 - нагружающий шток
Достоинствами этого метода являются: возможность варьирования частоты в широких пределах, независимость частоты от температуры и свойств исследуемого материала, а также отсутствие необходимости изменения размеров образцов при снятии частотных зависимостей. Недостатком этого метода является ограниченность диапазона охватываемых частот со стороны его верхней границы.
2.3 Измерение напряжения при деформации
Зависимости напряжения-деформации при растяжении определяют следующим образом. Образец, имеющий форму двойной лопатки, растягивают с постоянной скоростью и регистрируют приложенную нагрузку и удлинение. После этого вычисляют напряжения и деформации:

Универсальный образец для испытаний ISO R527

Диаграмма напряжений
А: Предел пропорциональности.
B: Предел текучести.
С: Предел прочности.
Х: Разрушение.
0-А: Область предела текучести, упругие свойства.
После А: Пластичные свойства.
2.4 Прочность и модуль упругости при изгибе ISO 178 (DIN 53452, ASTM D790)

Рис. 6. Современная установка для испытаний на изгиб: "Флексометр"
Прочность на изгиб является мерой, показывающей, насколько хорошо материал сопротивляется изгибу, или "какова жесткость материала". В отличие от нагрузки при растяжении, при испытаниях на изгиб все силы действуют в одном направлении. Обыкновенный, свободно опертый стержень нагружается в середине пролета: тем самым создается трехточечное нагружение. На стандартной машине для испытаний нагружающий наконечник давит на образец с постоянной скоростью 2 мм/мин.
Для вычисления модуля упругости при изгибе по зарегистрированным данным строится кривая зависимости прогиба от нагрузки. Начиная от исходной линейной части кривой, используют минимум пять значений нагрузки и прогиба.
Модуль упругости при изгибе (отношение напряжения к деформации) наиболее часто упоминают при ссылке на упругие свойства. Модуль упругости при изгибе эквивалентен наклону линии, касательной к кривой напряжения/деформации, в той части этой кривой, где пластик еще не деформировался.
Значения напряжений и модуля упругости при изгибе измеряются в МПа.

Испытания на изгиб
2.5 Испытания на прочность при ударе
Понятие прочности при ударе
При стандартных испытаниях, например, испытаниях на растяжение и изгиб, материал поглощает энергию медленно. Реально материалы очень часто быстро поглощают энергию приложенного усилия, например, усилия от падающих предметов, ударов, столкновений, падений и т.д. Целью испытаний на прочность при ударе является имитация таких условий.
Для исследования свойств определенных образцов при заданных ударных напряжениях и для оценки хрупкости или ударной вязкости образцов применяются методы Изода и Шарпи. Результаты испытаний по этим методам не должны использоваться как источник данных для проектных расчетов компонентов. Информация о типовых свойствах материала может быть получена посредством испытания разных типов испытуемых образцов, приготовленных в различных условиях, с изменением радиуса надреза и температуры испытаний.
Испытания по обоим методам проводятся на ударном маятниковом копре. Образец зажимают в тисках, а маятниковый копер с закаленной стальной ударной поверхностью определенного радиуса отпускают с заданной высоты, что вызывает срез образца от резкой нагрузки. Остаточная энергия маятникого копра поднимает его вверх. Разность высоты падения и высоты возврата определяет энергию, затраченную на разрушение испытуемого образца. Эти испытания могут проводиться при комнатной температуре либо при пониженных температурах для определения хладноломкости. Испытуемые образцы могут быть разными по типу и размерам надрезов.
Результаты испытаний на удар падающим грузом, например, по методу Гарднера или изогнутой плитой, зависят от геометрии падающего груза и опоры. Их можно использовать только для определения относительного ранжирования материалов. Результаты испытаний на удар не могут считаться абсолютными, кроме случаев, когда геометрия испытательного оборудования и образца соответствуют требованиям конечного применения. Можно ожидать, что относительное ранжирование материалов по двум методом испытаний будет совпадать, если характер разрушения и скорости удара одинаковы .
Интерпретация результатов испытаний на удар - сравнение методов ISO и ASTM
Ударные характеристики могут в большой степени зависеть от толщины образца и ориентации молекул. Разные толщины образцов, используемых в методах ISO и ASTM, могут весьма значительно повлиять на значения прочности при ударе. Изменение толщины с 3 мм на 4 мм может даже привести к переходу характера разрушения от вязкого к хрупкому из-за влияния молекулярной массы и толщины образца с надрезом при использовании метода Изода, как это продемонстрировано для поликарбонатных смол. На материалы, уже показывающие хрупкий характер разрушения при толщине 3 мм, например, материалы с минеральными и стекловолоконными наполнителями, изменение толщины образца не влияет. Такими же свойствами обладают материалы с модифицирующими добавками, увеличивающими ударную прочность.

Влияние толщины и молекулярной массы образца с надрезом на результаты ударных испытаний поликарбонатных смол по Изоду
Ударная прочность по Изоду ISO 180 (ASTM D256)

Рис. 7 Лабораторный прибор для измерения ударной прочности по Изоду
Испытания образцов с надрезом на ударную прочность по Изоду стали стандартным методом для сравнения ударной прочности пластиков. Однако результаты этого метода испытаний мало соответствуют реакции формованного изделия на удар в реальной обстановке. Из-за разной чувствительности материалов к надрезу этот метод испытаний позволяет отбраковывать некоторые материалы. Несмотря на то, что результаты этих испытаний часто запрашивались как значимые меры ударной прочности, эти испытания проявляют тенденцию к измерению чувствительности материала к надрезу, а не к способности пластика выдерживать удар. Результаты этих испытаний широко используются как справочные для сравнения ударных вязкостей материалов. Испытания образцов с надрезом на ударную прочность по Изоду лучше всего применимы для определения ударной прочности изделий, имеющих много острых углов, например ребер, пересекающихся стенок и других мест концентрации напряжений. При испытаниях на ударную прочность по Изоду образцов без надреза, применяется та же геометрия нагружения, за исключением того, что образец не имеет надреза (или зажат в тисках в перевернутом положении). Испытания этого типа всегда дают более высокие результаты по сравнению с испытаниями образцов с надрезом по Изоду из-за отсутствия места концентрации напряжений.
Ударной прочностью образцов с надрезом по методу Изода является энергия удара, затраченная на разрушение надрезанного образца, деленная на исходную площадь поперечного сечения образца в месте надреза. Эту прочность выражают в килоджоулях на квадратный метр: кДж/м2. Образец вертикально зажимают в тисках ударного копра.
ISO 180/1A обозначает тип образца 1 и тип надреза А. Как можно увидеть на рисунке ниже, образец типа 1 имеет длину 80 мм, высоту 10 мм и толщину 4 мм.
ISO 180/1O обозначает тот же образец 1, но зажатый в перевернутом положении (указываемый как "ненадрезанный").
Образцы, используемые по методу ASTM, имеют подобные размеры: тот же радиус скругления у основания надреза и ту же высоту, но отличатся по длине - 63,5 мм и, что более важно, по толщине - 3,2 мм.
Результаты испытаний по ISO определяют как энергию удара в джоулях, затраченную на разрушение испытуемого образца, деленную на площадь поперечного сечения образца в месте надреза. Результат выражают в колоджоулях на квадратный метр: кДж/м2.
Результаты испытаний по методу ASTM определяют как энергию удара в джоулях, деленную на длину надреза (т.е. толщину образца). Их выражают в джоулях на метр: Дж/м. Практический коэффициент пересчета равен 10: т.е. 100 Дж/м равно приблизительно 10 кДж/м2.
Разная толщина образцов может отразиться на различных интерпретациях "ударной прочности", как показано отдельно.

Образцы для измерения ударной прочности

Рис. 8. Метод измерения ударной прочности по Изоду
Ударная прочность по Шарпи ISO 179 (ASTM D256)
Основным отличием методов Шарпи и Изода является способ установки испытуемого образца. При испытании по методу Шарпи образец не зажимают, а свободно устанавливают на опору в горизонтальном положении.
Обозначения ISO отражают тип образца и тип надреза:
ISO 179/1C обозначает образец типа 2 и надрез типа CI;
ISO 179/2D обозначает образец типа 2, но ненадрезанный.


Образцы, используемые по методу DIN 53453, имеют подобные размеры. Результаты по обоим методам ISO и DIN определяются как энергия удара в джоулях, поглощенная испытуемым образцом, деленная на площадь поперечного сечения образца в месте надреза. Эти результаты выражаются в килоджоулях на квадратный метр: кДж/м 2 .
Методика изучения радиотермолюминесценции (РТЛ) полимеров
Многие неорганические и органические вещества, подвергнутые при низких температурах (обычно при 77 К) проникающей радиации, при последующем разогреве начинают светиться, т.е. спектр их высвечивания находится в видимой области.
Применение метода РТЛ включает в себя три операции: облучение исследуемого образца при низкой температуре, последующий плавный разогрев облученного образца и одновременно с ним регистрацию свечения. При облучении веществ происходит стабилизация электронов и "дырок" в ловушках, которыми являются дефекты их структуры. Рекомбинация зарядов приводит к люминесценции облученного вещества. В зависимости от способа активации зарядов различаются термо-, фото- и другие виды люминесценции. На температурной зависимости интенсивности РТЛ могут быть один или несколько максимумов, что указывает на существование одного или нескольких типов ловушек в данном облученном веществе. Для неорганических веществ эти максимумы в общем случае не связаны с их молекулярной подвижностью.
Характерной особенностью РТЛ органических веществ и в первую очередь полимеров, является то, что максимумы свечения на кривой РТЛ проявляются в тех интервалах температур, где имеют место различные кинетические и структурные переходы. Посредством сравнения значений температур максимумов РТЛ и релаксационных переходов, обнаруженных другими методами (механических и диэлектрических потерь, термомеханических кривых и ЯМР), было показано, что они проявляются в областях размораживания подвижности различных кинетических единиц. Такое совпадение максимумов свечения РТЛ с областями кинетических и структурных переходов в полимерах дает основание считать, что акты рекомбинации зарядов осуществляются за счет размораживания теплового движения кинетических единиц, на которых находятся электронные ловушки или центры свечения. При этом время жизни электрона в ловушке будет определяться временем релаксации кинетической единицы, на которой находятся стабилизированные электроны.
Для каждого полимера характерна вполне определенная кривая высвечивания. Положение максимумов РТЛ зависит от дозы предварительного облучения, с увеличением дозы в результате сшивания полимера температура максимума смещается в сторону высоких температур. Для совместимых смесей полимеров характерно наличие лишь одного максимума РТЛ при температуре стеклования смеси, причем его положение меняется при изменении соотношения компонентов. Кривые РТЛ гетерогенных смесей полимеров представляют собой сумму кривых высвечивания отдельных компонентов, взятых в определенном соотношении. Все это свидетельствует о том, что РТЛ облученных полимеров в первую очередь определяется процессами молекулярного движения. Изучая РТЛ полимеров, удается определить не только температуры структурных и кинетических переходов, но и получить сведения об их характере и об активационных параметрах процессов молекулярного движения.
С помощью метода РТЛ удается надежно зарегистрировать изменение температуры стеклования даже тогда, когда оно составляет всего 2-3 градуса. К достоинствам метода РТЛ относится, несомненно, и то, что образец полимера может быть в любом виде.
2.6 Световая (оптическая) микроскопия
Этот метод состоит в том, что исследуемый объект рассматривается в оптическом микроскопе в проходящем или отраженном свете, и в плоскости изображения объективной линзы микроскопа формируется увеличенное изображение предмета.
Обычное наблюдение полимерных образцов в оптическом микроскопе «на просвет» в неполяризованном свете малоинформативное из-за малой разности оптических плотностей различных структурных элементов. Положение существенно улучшается при использовании поляризованного света, поскольку кристаллизация и ориентация полимеров приводят к появлению эффекта двойного лучепреломления.
Длина волн видимого света составляет 0,4 – 0,8 мкм. Поэтому оптические методы позволяют различать структурные элементы размером от нескольких до многих сотен микрон.
Метод оптической микроскопии обычно не требует специального препарирования исследуемых объектов. Наиболее удобны для изучения в проходящем свете образцы в виде тонких пленок или срезов с массивных блоков.
Методы оптической микроскопии используются при исследовании структурных образований в кристаллических полимерах, для наблюдения за структурными превращениями при кристаллизации и исследования кинетики этого процесса, контроля за макроскопической структурой материала, полученного в различных технологических условиях, а также наблюдения за структурными превращениями под влиянием различных взаимодействий (деформационных, тепловых и т.п.).
2.7 Электронная микроскопия
В электронных микроскопах источником излучения служит катод, испускающий пучок электронов (электронный луч). Перемещению электронов в пространстве соответствуют колебания определенной длины волны, зависящей от ускоряющего напряжения.
Как и в световом микроскопе, в электронном микроскопе можно наблюдать увеличенное изображение объекта, которое, однако, нельзя рассматривать как снимок, сделанный простым фотоаппаратом. Для правильной интерпретации электронно-микроскопических снимков (изображений) необходимо знать законы взаимодействия электронов с исследуемым веществом.
Методом электронной микроскопии исследуют очень тонкие слои вещества порядка 1000А0 и меньше. Это могут быть очень тонкие пленки или срезы Структуру поверхности блочных материалов или поверхностей разлома исследуют с помощью метода рекчик, т.е. прозрачных отпечатков с поверхности исследуемого образца.
Возникновение контраста на электронно-микроскопических снимках связано с различной рассеивающей способностью ядер разных атомов по отношению к электронному пучку.
Атомы тяжелых металлов наиболее сильно рассеивают электроны, поэтому часто для увеличения контраста полимерных объектов их оттеняют тяжелыми металлами, такими, как хром, палладий, золото, платина и т.п.
Важными ограничением метода электронной микроскопии является его статический характер, обусловленный трудностями приготовления образцов, и возможность существенных ошибок в определении структуры.
2.8 Рентгеноструктурный анализ
Рентгеноструктурный анализ основан на использовании рентгеновского излучения, длина волн которого лежит в интервале от 0,1 до 100А 0 . На практике для исследования полимеров наиболее широко используют антикатод рентгеновской трубки, изготовленной из меди. Из испускаемого излучения никелевым фильтром отбирается - линия с длиной волны 1,54 А 0 .
Теория рентгеноструктурного анализа основана на гипотезе Гюйгенса – Френеля. Согласно этой гипотезе, точка, до которой доходит электромагнитное колебание, может в свою очередь рассматриваться как центр излучения (рис. 9).
На нем показана одномерная структура, на которую падает параллельный пучок лучей S 0 . Каждый узел, показанный на схеме рассматривается как источник колебаний, создающих лучи S. Эти лучи интерферируют в плоскости экрана. При этом существуют такие точки на экране, положение которых характеризуется углом между направлением падающего угла и отражающей плоскости, в которых интенсивность интерференции лучей, дифрагированных во всех узлах структур, минимальна.

Рис. 9. Схема отражения лучей от одномерной структуры с периодом d.
Угол определяется по формуле Вульфа – Брэгга:
![]() (1)
(1)
где d – период одномерной структуры (расстояние между плоскостями);
длина волны падающего излучения;
n - целые числа, называемые порядком отражения (1,2,3…). Для трехмерной решетки с периодом идентичности в каждом направлении a,b и c должны выполняться три дифракционных условия:
![]()
![]() (1.1)
(1.1)
![]()
где m, n, k целые числа.
Однако три угла в пространстве не могут быть выбраны произвольно поскольку углы между произвольной прямой и тремя взаимно перпендикулярными координатными осями a,b,c связаны геометрическим уравнением:
Уравнения (1.1) и (1.2) называются уравнениями Лауэ. Приведенные формулы позволяют вычислить размеры периодов идентичности d. Так, если используется монохроматические излучения с известной длиной волны и экспериментально определены углы , в которых максимальна интенсивность рассеянного излучения, то d легко находится по формуле Вульфа – Брэгга.
Структурная упорядоченность расположения макромолекул и их частей обусловливает существование нескольких уровней периодичности, характеризуемых своими размерами (величиной периода).
В полимерах различают три основных вида упорядоченности:
а) Малый период - это размеры элементарной кристаллографической решетки, т.е. наименьшего структурного элемента («кирпичика»), путем различных сочетаний, на которых построены все кристаллические тела.
б) Шаг спирали характеризует периодичность вдоль цепи и имеет размеры порядка нескольких десятков A 0 . Это специфическая характеристика макромолекулы определенного химического строения.
в) Большие периоды характеризуются размерами в сотни A 0 .
Рентгеноструктурный анализ позволяет получать обширную информацию о строении полимеров и его изменении в результате тепловых, механических и других воздействий, о фазовых превращениях и конформации макромолекул, о характере ориентации кристаллографических и молекулярных осей в кристаллографической ячейке и их изменении в результате внешних воздействий. Кроме того, рентгеноструктурный метод дает возможность определять средние размеры и распределение по размерам кристаллов, степень дефектности кристаллической структуры и многое другое.
Если в материале существуют упорядоченные частицы с характерными расстояниями d (межплоскостные расстояния) между ними, причем d соизмеримо или больше длины волн рентгеновского и излучения, то наблюдатель видит картину интерференции дифрагированных лучей, по которой можно судить о значениях d.
Дифракция рентгеновских лучей под малыми углами дает основание для суждения о величине большого периода и его изменение при различных термомеханических воздействиях, о состоянии (плотности) аморфных прослоек, а также позволяет регистрировать возникновение мельчайших трещин в полимерах. Особая ценность методов рентгеноструктурного анализа состоит в том, что они не требуют специального препарирования объектов и позволяют изучать структуру полимеров и ее превращения непосредственно под действием внешних полей, в частности тепловых и механических.
2.9 Электронография
Электронография – это метод исследования строения вещества, основанный на дифракции электронов. Принципы электронографии практически ничем не отличаются от основ рентгеноструктурного анализа.
Электроны интенсивно поглощаются веществом, поэтому электронографические исследования проводятся в глубоком вакууме на очень тонких слоях веществах (10 -7 - 10 -6 см).
Длина волны электронов значительно меньше длины волны рентгеновских лучей, поэтому метод электронографии позволяет получать информацию об упорядоченности структуры полимера на значительно более мелких участках образца. В этом состоит определенное преимущество электронографического метода перед рентгеноструктурным, однако, необходимо учитывать, что поток электронов может приводить к структурным превращениям полимеров, в частности разрушать упорядоченности и иногда даже вызывать деструкцию макромолекул с образование макрорадикалов.
Нейтронография
Метод нейтронографии основан на эффекте рассеяния потока медленных нейтронов атомными ядрами вещества. Контраст появляется вследствие различия интенсивности рассеяния монохроматического потока нейтронов на ядрах различной массы, причем существенно, что в отличие от рентгеновских лучей и электронов поток нейтронов не несет электрического заряда и, следовательно, интенсивность их рассеяния определяется только массой ядра. Практически применение метода нейтронографии основывается на сравнении интенсивности рассеяния на ядрах водорода и дейтерия при исследовании системы, содержащей некоторое количество дейтерированных молекул в среде водородосодержащих цепей, или наоборот. Контраст в этом случае особенно велик из-за двукратного изменения рассеивающей массы. Источником потока нейтронов обычно являются ядерные реакторы. Длина волны потока зависит от энергии нейтронов, области температуры 20-1000С отвечают значения , равные 1,6 – 1,8 A 0 . Используя «холодные» нейтроны, получают пучки с длинами волн до 10 A 0 .
В настоящее время нейтронография применяется для оценки размера макромолекул в твердом стеклообразном полимере.
2.10 Исследование полимеров методом уф-спектроскопии
Ультрафиолетовая (УФ) спектроскопия охватывает коротковолновую область оптического диапазона и с одной стороны примыкает к видимой области спектра, а с другой – к рентгеновской. Длины волн УФ и видимой областей принято выражать в нанометрах (нм). Весь УФ-спектр делят на ближний с длиной волны 400-300 нм, дальний – 300-200 нм и вакуумный с длиной волны 200-50 нм.
В УФ-спектроскопии используют и спектры излучения, и спектры поглощения. При исследовании полимеров пользуются в основном спектрами поглощения.
При воздействии света УФ и видимого диапазонов длин волн происходит возбуждение электронных оболочек молекул вещества, что обусловлено переходом валентных электронов, а также неспаренных электронов из основного состояния в возбужденное с более высокой энергией. Это сопровождается появлением полос поглощения в спектре при длинах волн, соответствующих разности энергий возбужденного и невозбужденного уровней. Каждому электронному уровню молекулы соответствует набор колебательно-вращательных уровней. Так как энергия возбуждения электронных оболочек молекулы значительно больше энергии возбуждения ее колебаний, то переход электронов обычно сопровождается изменением колебательно-вращательного состояния молекулы. Поэтому молекулярно-электронные спектры жидкостей и твердых тел состоят из широких полос.
Избирательное поглощение в УФ и видимых областях спектра характерно для ненасыщенных соединений. Их поглощение определяется наличием в ненасыщенных связей легко возбудимых п-электронов. Группы атомов, ответственные за избирательное поглощение, называют хромофорами.
Положение полос поглощения хромофоров и их интенсивность могут значительно изменяться в зависимости от природы групп атомов, присоединенных к молекуле, содержащей хромофор, и не имеющих собственного поглощения. Такие группы называются ауксохромами.
Как и большинство насыщенных соединений, не содержащих кратных связей, полимеры прозрачны в в ближней УФ и видимой областях спектра (полиолефины, полимеры сополимеры хлор- и фторпроизводных этилена, поливиниловый спирт и т.д.). Полимеры сложных эфиров акриловых кислот (полиакрилат, полиметилакрилат), поливиниловые сложные эфиры (поливинилацетали и т.п.), а также полимерные эфиры карбоновых кислот, содержащие карбонильный хромоформ, поглощают на границе вакуумной УФ-области (около 200 нм). Полимеры, содержащие карбоксильный хромоформ или бензольные кольца, поглощают в значительной части УФ-области. Спектры полимеров в УФ-области, как правило, невыразительны и не имеют практического применения для исследования структуры.
УФ-спектры широко используются также для исследований донорно-акцепторного взаимодействия в радикальной полимеризации. Отмечено, что в спектрах молекулярных комплексов донорно-акцепторного типа могут наблюдаться полосы поглощения, характерные для свободных донора (Д) и акцептора (А), а также полосы «переноса заряда», соответствующие различным возбужденным состояниям Д и А. Коэффициент поглощения для свободных доноров и акцепторов модно вычислить из оптической плотности растворов известной концентрации чистых компонентов; в большинстве случаев только часть донора или акцептора входят в состав комплекса даже в присутствии большого избытка другого компонента.
УФ-спектроскопия позволяет исследовать твердые полимеры (пленки, порошки, таблетки, получаемые из тонкоизмельченной примеси полимера и бромида калия) и их растворы.
При исследовании растворов используют растворители, поглощающие свет в области длин волн менее 200 нм, например, предельные углеводороды (гексан, гептан), циклогексан. Можно использовать хлороформ этилацетат, дихлорэтан, этилацетат, которые поглощают свет в области менее 250 нм, а также воду, спирты, и другие соединения, прозрачные для того диапазона УФ-излучения, который обычно используют в аналитических целях. Выбор растворителя ограничивается растворимостью полимеров и также возможностью искажения спектров вследствие реакций комплексообразования и ассоциаций между растворенным веществом и растворителем.
Существует два основных типа приборов для УФ-спектроскопических исследований – однолучевой и двулучевой, каждый из которых имеет свои преимущества и недостатки. Однолучевой прибор, измеряющий оптическую плотность по отдельным точкам, в сочетании с измерительной системой по схеме уравновешенного моста является наилучшим прибором для точных количественных измерений, однако работа на нем трудоемка и долговременна. Двухлучевой регистрирующий прибор позволяет получать хорошие спектры для качественного изучения, однако для количественных целей он менее точен, чем однолучевой.
Однолучевые спектрофотометры СФ-26 и СФ-16 предназначены для измерения пропускания и оптической плотности растворов и твердых веществ в диапазоне 186-1100 нм. Спектрофотометр СФ-26 поставляется в двух вариантах – основном и дополнительном, включающем цифровой вольтметр Щ1213, который используется вместо стрелочного прибора для более объективного измерения пропускания (оптической плотности). Однолучевой спектрофотометр СФ-46 со встроенной микропроцессорной системой предназначен для измерения пропускания, оптической плотности жидких и твердых веществ в области 190-1100 нм. Диспергирующим элементом служит дифракционная решетка с переменным шагом и криволинейным штрихом.
Регистрирующие двухлучевые спектрофотометры СФ-10, СФ-14, СФ-16 предназначены для измерения пропускания и оптической плотности прозрачных и мутных сред и коэффициентов диффузного отражения твердых и порошкообразных веществ в видимой области спектра (от 400 до 750 нм). Спектрофотометры состоят из осветителя, двойного призменного монохроматора, фотометра поляризационного типа, премно усилительной части и записывающего механизма .
2.11 Оптические испытания
Мутность и светопропускание ASTM D1003
Мутность вызывается рассеянием света в материале и может быть следствием влияния молекулярной структуры, степени кристаллизации либо посторонних включений на поверхности или внутри образца полимера. Мутность свойственна только полупрозрачным или прозрачным материалам и не относится к непрозрачным материалам. Мутность иногда считают противоположностью к глянцу, который собственно может быть поглощением падающего пучка света. Однако согласно методу испытания на мутность, фактически измеряют поглощение, пропускание и отклонение луча света полупрозрачным материалом.
Образец помещают на пути узкого пучка света таким образом, что часть света проходит через образец, а другая часть не встречает препятствия. Обе части пучка проходят в сферу, оснащенную фотодетектором.
Можно определить две величины:
Общую интенсивность пучка света;
Количество света, отклоненного более чем на 2,5° от исходного пучка.
По этим двум величинам можно вычислить следующие два значения:
Мутности, или процента подающего света, рассеянного более чем на 2,5° и коэффициента светопропускания, или процента падающего света, который пропускается через образец.
Глянец DIN 67530, ASTM D523
Глянец связан со способностью поверхности отражать больше света в некотором направлении по сравнению с другими направлениями. Глянец можно измерить с помощью глянцемера. Яркий свет отражается от образца под углом, а яркость отраженного света измеряют фотодетектором. Наиболее часто используют угол 60°. Более блестящие материалы можно измерять под углом 20°, а матовые поверхности - под углом 85°. Глянцемер калибруют при помощи эталона из черного стекла, имеющего значение глянца 100.
Пластики имеют меньшие значения - они строго зависят от способа формования.

Рис. 10. Метод измерения глянца
В методах испытаний мутности и глянца измеряют, насколько хорошо материал отражает или пропускает свет. Эти методы количественно определяют классификацию материала, например "прозрачный" или "блестящий". Тогда как мутность свойственна только прозрачным или полупрозрачным материалам, глянец можно измерить для любого материала. Оба вида испытаний на мутность и глянец являются точными. Но они часто используются для оценки внешнего вида, который более субъективен. Корреляция между значениями мутности и глянца, а также то, как люди оценивают "прозрачность" или "блеск" пластика, являются неопределенными .
2.12 Инфракрасная спектроскопия (FTIR)
Позволяет определять химические структуры и их изменения в полимерах и добавках за счет передачи информации или прямого отражения от поверхностей деталей, пленок, покрытий, ламинатов, помутнений и загрязнений поверхности. Ее также можно использовать для изучения остаточной ненасыщенности, сшивания, развития ингредиентов, включений. Программное обеспечение для сопоставительных спектров, включая пиролизатные спектры, облегчает идентификацию полимеров и добавок.
Инфракрасная микроспектроскопия позволяет исследовать небольшие пятна, включения и прочие дефекты или разрушения местного характера. Некоторые системы предназначены для встроенной идентификации пластмасс, такие как, например, Matrix PID от Bruker Optics (см. фото "Matrix PID", любезно предоставленное Bruker Optics)
Жирные кислоты, их соли, сложные эфиры и амиды, используемые в качестве смазочных веществ или веществ, улучшающих обрабатываемость, термостабилизаторы PVC, эмульгаторы…
Хвойные производные: сосновый деготь, канифоль, терпен, используемые в качестве веществ для повышения клейкости или веществ, улучшающих обрабатываемость.
Вулканизированные растительные масла или фактисы, используемые в каучуковых рецептурах.
Производные фенола, используемые в качестве антиоксидантов.
Жидкий деполимеризованный натуральный каучук, используемый в качестве сшиваемого полимерного пластификатора.
Эпоксидированное соевое масло, используемое в качестве пластификатора…

Рисунок 11: Matrix PID
FTIR может сочетаться с пиролизом, что упрощает приготовление образца, или же с гельпроникающей хроматографией, которая позволяет пролить свет на развитие химических структур .
Глава 3. Экспериментальная часть
3.1 Мои уроки
Урок 1. Тема урок. Понятие о высокомолекулярных соединениях
Цель урока: Систематизировать и углубить знания учащихся о высокомолекулярных веществах.
Задачи : 1. ввести понятия – мономер, полимер, степень полимеризации, структурное звено, средняя молекулярная масса. 2. Ознакомить с разными структурами полимеров (линейной, разветвлённой и др.). 3. научить доказывать влияние строения полимеров на их свойства. Ученики должны узнать сущность реакций полимеризации и поликонденсации, уметь записывать уравнения химических реакций.
Материалы и оборудование: моделимолекул этилена, пропилена, хлорвинила, стирола; выставка изделий из пластмасс и полимеров.
Тип урока: комбинированный, с элементами беседы и лекции.
1.Организационый момент , т.е. приветствие, проверка присутствующих (1-2 мин.).
I. Опрос домашнего задания и подготовка к восприятию нового материала (10-12 мин.).
Фронтальная беседа.
Вопросы:
Какие углеводороды вы знаете?
Ответ: В органической химии различают предельные углеводороды (алканы), непредельные (алкены, алкадиены и алкины) и ароматические углеводороды.
2.Какие углеводороды называются непредельными и как их подразделяют? Напишите общие формулы непредельных углеводородов?
Ответ. Непредельными называются углеводороды, молекулы которых содержат кратные (двойные или тройные) связи. Общая формула углеводородов, содержащих одну двойную связь (алкенов) – CnH 2n . Общая формула углеводородов с двумя двойными связями (диенов) - CnH 2n-2 . Такую же формулу имеют УВ с одной тройной связью (алкины).
3. Какие из углеводородов способны вступать в реакцию полимеризации?
Ответ: В реакции полимеризации способны вступать алкены, диеновые углеводороды, алкины. Из ароматических углеводородов стирол участвует в реакциях полимеризации.
4. Почему именно из этих углеводородов можно получить полимеры?
Ответ: Непредельные углеводороды вступают в реакцию полимеризации из-за наличия у них в молекулах кратных связей, которые разрываются вследствие соединения молекул друг с другом.
Участие стирола в реакции полимеризации объясняется тем, что в боковой цепи его молекул содержится непредельный радикал винил.
II. Изучение нового материала (20-25 мин.).
Полимеры – высокомолекулярные соединения, вещества с большой молекулярной массой (от нескольких тысяч до нескольких миллионов), в которых атомы, соединенные химическими связями, образуют линейные или разветвленные цепи, а также пространственные трехмерные структуры. К полимерам относятся многочисленные природные соединения: белки, нуклеиновые кислоты, целлюлоза, крахмал, каучук и другие органические вещества. Большое число полимеров получают синтетическим путем на основе простейших соединений элементов природного происхождения путем реакций полимеризации, поликонденсации, и химических превращений.
1.Значение высокомолекулярных соединений.
2.Основные понятия (например, реакций полимеризации этилена):
мономер, полимер, структурное звено, степень полимеризации.
3. Геометрическая структура или форма макромолекулы полимеры:
линейная, разветвленная, пространственная.

4. Характеристика молекулярной массы полимера.
5. Свойства полимеров:
высокая механическая прочность, не имеют определённой температуры плавления и кипения, отсутствие летучести, вязкость растворов, нерастворимость в воде.
6. Способы получения (синтеза) полимеров:
а) Реакция полимеризации; б) Реакция поликонденсации
1. Полимеризация - это процесс образования высокомолекулярных соединений по цепному механизму без выделения низкомолекулярного соединения.
2. Полиприсоединения - это процесс образования высокомолекулярных соединений по ступенчатому механизму без выделения низкомолекулярных продуктов.
3. поликонденсация – это получение высокомолекулярного соединения по ступенчатому механизму с выделением низкомолекулярного продукта.
7. Экологические проблемы, связанные с полимерами.
Синтетические полимеры имеют определенные преимущества по сравнению с другими материалами (например, древесиной или сталью), поэтому они находят широкое практическое применение. Однако ликвидация отходов, содержащих синтетические полимеры, представляет чрезвычайно серьезную экологическую проблему. Например, при сжигании поливинилхлорида на мусоросжигательных заводах могут образовываться диоксины и выделяться тяжелые металлы. Кроме того, синтетические полимеры имеют низкую термостойкость, при нагревании они разлагаются с образованием токсичных продуктов. Некоторые синтетические полимеры выделяют вредные для здоровья пары (особенно фенолформальдегидные смолы, используемые в качестве связывающих веществ в древесно-стружечных плитах и покрытиях).
Знаете ли вы что…
1. Сложность повторного использования резины из старых шин связана с тем, что она вулканизированная.
Американские ученые обнаружили в горячих источниках Йеллоустонского национального парка бактерии, которые способны переваривать серные мостики в вулканизированной резине. Получается сырая резина, которая в количестве до 20 % можно вводить в массу для изготовления новых шин.
2. Применение отслужившим шинам свое автомобильным шинам нашла австралийская фирма «Марвел-Линк». Там из старых шин делают резиновый порошок, который можно использовать тремя способами. Во-первых, порошок из старой резины можно в количестве до 50 % добавлять в новую резину при изготовлении новых шин. Во-вторых, после специальной обработки такой порошок сильно поглощает нефть и может использоваться для сбора нефти, разлитой при разных авариях, в том числе и с поверхности воды. В-третьих, резиновым порошком можно засыпать городские свалки, ведь сейчас для этого тратится ценный стройматериал – крупный карьерный песок.
8.Общий вывод по уроку.
III. Закрепление знаний по пройденной теме (5 мин.).
1.Задание на дом.
Записи в тетради, упражнения 1-3.
2. Фронтальная беседа.
а) Почему структурным звеном полиэтилена считают − CH 2 − CH 2 −, а не − CH 2 − ?
б) Широко распространённый полимер полихлорвинил (поливинилхлорид) имеет строение:

Найдите структурное звено полимера и определите структурную формулу мономера.
в) Полиэтилен с молекулярной массой около 500 представляет собой вязкую жидкость. Вычислите степенью полимеризации такого полиэтилена.
Урок 2. Тема. Синтетические волокна
Цель урока: 1. Обобщить и углубить знания учащихся о волокнах, их классификации, строении, свойствах. Ввести понятие синтетических волокон.
Научить записывать в общем виде уравнения получения синтетических волокон 3. Научить учащихся сравнивать, обобщать, высказывать суждение о свойствах веществ на основе их строения.
Тип урока: лекция.
Ход урока
I. Подготовка к восприятию нового материала.
Фронтальная беседа.
1. Как классифицируют волокна?
2. Какие вы знаете волокна? Каковы их свойства? Где они применяются?
II. Изучение нового материала.
1. Кратко о классификации волокон.
Демонстрация: «Коллекция волокон», «Образцы синтетических волокон».
2. Синтетическое волокно – лавсан: объяснить его название, сырьё, свойства и применения.
3. Синтетическое волокно – капрон: сырьё, свойства и применения.
III. Закрепление новых знаний.
1.Задание на дом.
Записи в тетради, упражнения 1-2, подготовка к практической работе.
Для практической работы перечертить таблицу, только написать полиэтилен, поливинилхлорид, фенол-формальдегидные смолы, капрон, полистирол. Для волокон – таблица, выписать хлопок, шерсть, лавсан, капрон.
2.Фронтальная беседа:
Самостоятельная работа по карточкам (на 10 мин.) по одному вопросу.
Карточка №1. Широко распространённый полимер полихлорвинил (поливинилхлорид) имеет строение:

Найдите структурное звено полимера и определение структурную формулу мономера.
Карточка №2. Какими признаками должны характеризоваться вещества, вступающие в реакции: а) полимеризации; б) поликонденсации? Приведите примеры.
Карточка №3. Опишите свойства полиэтилена и полипропилена. Где они применяются?
Урок 3. Тема. Распознание пластмасс и химических волокон.
Тип урока: Практическая работа
Цель урока: 1. Закрепить и углубить знания учащихся о пластмассах и химических волокнах. 2.Научить умению определять пластмассы и химические волокна, соблюдать правила по технике безопасности при работе с органическими веществами.
Ход урока
I. Подготовка к выполнению практической работы.
1. Беседа учителя о правилах по технике безопасности при работе с органическими веществами. 2. Порядок выполнения работы (беседа).
II. Проведение практической работы.
Для проведения практической работы использовать, свои таблицы и практическую работу, в учебнике для 11 класса .
Распознавание пластмасс следует начать с внешнего осмотра, а затем перейти к исследованию их отношения к нагреванию и горению. Потом испытывают действие на них растворителей.
Распознавание волокон начинают с их сжигания. При этом прослеживают, с какой скоростью происходит горение, исследуют запах продуктов разложения, свойства остатка, который образуется после горения. Затем проверяют действие на волокна кислот, щелочей и растворителей.
Например, в отдельных пакетах под номерами разложены разные пластмассы: № 1– поливинилхлорид; № 2 – полиэтилен; № 3 – полистирол; № 4 – фенол-формальдегидная пластмасса; №5 –капрон. В других пакетах под номерами – образцы волокон: № 1 – шерсть; № 2- хлопок; № 3 – вискоза; № 4 – ацетатное волокно; № 5 – лавсан. Учащиеся берут из каждого пакета образцы волокон и пластмасс и исследуют их (по продуктам сжигания, действию кислот, щелочей и т. д.). После определения данного образца они ставят соответствующий номер в своей таблице.
2. Приведение в порядок своего рабочего места. Выводы по работе, необходимые записи.
III. Закрепление знаний, умений, навыков.
Подготовка к следующей теме. .
3.1.1 Констатирующий срез знаний
В качестве среза был проведен письменный опрос на следующие вопросы:
1. Что такое полимеры?
2. Что такое мономер?
3. Что такое степень полимеризации?
4. Что вы понимаете под словом полимеризация?
5. Дайте определение поликонденсации.
6. Отличие полимеризации от поликонденсации.
7. В чем отличие термопластов от термореакторов?
8. Что вы знаете о полимерах?
9. Какие изделия из полимеров вам знакомы?
Результаты ответов как оказалось не так уж и плохи, некоторые получили положительные оценки.
3.2 Изложение материала в университете