Keemiline tasakaal. Keemiline tasakaal: keemiline tasakaalukonstant ja selle väljendamise meetodid Mis iseloomustab tasakaalukonstandi arvväärtust
Enamik keemilisi reaktsioone on pöörduvad, s.t. voolavad samaaegselt vastassuundades. Juhtudel, kui edasi- ja vastupidised reaktsioonid toimuvad sama kiirusega, tekib keemiline tasakaal. Näiteks pöörduvas homogeenses reaktsioonis: H 2 (g) + I 2 (g) ↔ 2HI (g) sõltub edasi- ja tagasisuunaliste reaktsioonide kiiruste suhe massimõju seaduse järgi kontsentratsioonide suhtest. reagentidest, nimelt: edasisuunalise reaktsiooni kiirus: υ 1 = k 1 [H 2 ]. Pöördreaktsiooni kiirus: υ 2 = k 2 2.
Kui H 2 ja I 2 on lähteained, siis esimesel hetkel määratakse edasisuunalise reaktsiooni kiirus nende algkontsentratsioonide järgi ja pöördreaktsiooni kiirus on null. Kui H 2 ja I 2 tarbitakse ja HI moodustub, siis edasisuunalise reaktsiooni kiirus väheneb ja vastupidise reaktsiooni kiirus suureneb. Mõne aja pärast võrdsustuvad mõlemad määrad ja süsteemis tekib keemiline tasakaal, s.t. ajaühikus toodetud ja tarbitud HI molekulide arv muutub samaks.
Kuna keemilises tasakaalus on päri- ja vastupidiste reaktsioonide kiirus V 1 = V 2, siis k 1 = k 2 2.
Kuna k 1 ja k 2 on antud temperatuuril konstantsed, on nende suhe konstantne. Tähistades seda K-ga, saame:

K nimetatakse keemilise tasakaalu konstandiks ja ülaltoodud võrrandit massimõju seaduseks (Guldberg – Waale).
Üldjuhul on reaktsioonil kujul aA+bB+…↔dD+eE+… tasakaalukonstant võrdne ![]() . Gaasiliste ainete vastastikmõju puhul kasutatakse sageli väljendit, milles reagendid on esindatud tasakaaluliste osarõhkudega p. Mainitud reaktsiooni eest
. Gaasiliste ainete vastastikmõju puhul kasutatakse sageli väljendit, milles reagendid on esindatud tasakaaluliste osarõhkudega p. Mainitud reaktsiooni eest  .
.
Tasakaaluseisund iseloomustab piiri, milleni reaktsioon antud tingimustes kulgeb spontaanselt (∆G<0). Если в системе наступило химическое равновесие, то дальнейшее изменение изобарного потенциала происходить не будет, т.е. ∆G=0.
Tasakaalukontsentratsioonide suhe ei sõltu sellest, millised ained võetakse lähteainetena (näiteks H 2 ja I 2 või HI), s.t. tasakaaluseisundile saab läheneda mõlemalt poolt.
Keemilise tasakaalu konstant sõltub reaktiivide olemusest ja temperatuurist; Tasakaalukonstant ei sõltu rõhust (kui see on liiga kõrge) ega reaktiivide kontsentratsioonist.
Mõju temperatuuri, entalpia- ja entroopiategurite tasakaalukonstandile. Tasakaalukonstant on seotud keemilise reaktsiooni standardse isobaar-isotermilise potentsiaali muutumisega ∆G o lihtvõrrandiga ∆G o =-RT ln K.
See näitab, et suured negatiivsed väärtused ∆G o (∆G o<<0) отвечают большие значения К, т.е. в равновесной смеси преобладают продукты взаимодействия. Если же ∆G o характеризуется большими положительными значениями (∆G o >>0), siis on tasakaalusegus ülekaalus lähteained. See võrrand võimaldab ∆G o väärtusest arvutada K ja seejärel reaktiivide tasakaalukontsentratsioonid (osarõhkud). Kui arvestada, et ∆G o =∆Н o -Т∆S o , siis pärast mõningast teisendust saame ![]() . Sellest võrrandist on selge, et tasakaalukonstant on temperatuurimuutuste suhtes väga tundlik. Reaktiivide olemuse mõju tasakaalukonstandile määrab selle sõltuvuse entalpia- ja entroopiateguritest.
. Sellest võrrandist on selge, et tasakaalukonstant on temperatuurimuutuste suhtes väga tundlik. Reaktiivide olemuse mõju tasakaalukonstandile määrab selle sõltuvuse entalpia- ja entroopiateguritest.
Le Chatelier’ põhimõte
Keemiline tasakaal säilib antud konstantsetes tingimustes igal ajal. Tingimuste muutumisel on tasakaaluseisund häiritud, kuna sel juhul muutuvad vastupidiste protsesside kiirused erineval määral. Kuid mõne aja pärast jõuab süsteem uuesti tasakaaluseisundisse, kuid seekord vastab uutele muutunud tingimustele.
Tasakaalu nihe sõltuvalt tingimuste muutumisest määratakse üldiselt Le Chatelier’ põhimõttega (või liikuva tasakaalu printsiibiga): Kui tasakaalus olevat süsteemi mõjutatakse väljastpoolt, muutes mistahes tasakaaluasendit määravaid tingimusi, siis see nihkub protsessi suunas, mille kulg nõrgestab tekitatava efekti mõju.
Seega põhjustab temperatuuri tõus tasakaalunihke nende protsesside suunas, mille käiguga kaasneb soojuse neeldumine, ja temperatuuri langus toimib vastupidises suunas. Samamoodi nihutab rõhu suurenemine tasakaalu protsessi suunas, millega kaasneb ruumala vähenemine, ja rõhu langus toimib vastupidises suunas. Näiteks tasakaalusüsteemis 3H 2 +N 2 2H 3 N, ∆H o = -46,2 kJ, suurendab temperatuuri tõus H 3 N lagunemist vesinikuks ja lämmastikuks, kuna see protsess on endotermiline. Rõhu tõus nihutab tasakaalu H 3 N tekke suunas, kuna ruumala väheneb.
Kui teatud kogus reaktsioonis osalevat ainet lisatakse tasakaaluseisundis olevale süsteemile (või vastupidi, eemaldatakse süsteemist), siis edasi- ja tagurpidireaktsiooni kiirused muutuvad, kuid võrdsustuvad järk-järgult uuesti. Teisisõnu, süsteem naaseb keemilise tasakaalu olekusse. Selles uues olekus erinevad kõigi süsteemis olevate ainete tasakaalukontsentratsioonid algsetest tasakaalukontsentratsioonidest, kuid nendevaheline suhe jääb samaks. Seega on tasakaalus olevas süsteemis võimatu muuta ühe aine kontsentratsiooni, põhjustamata muutust kõigi teiste kontsentratsioonides.
Vastavalt Le Chatelieri põhimõttele põhjustab täiendavate reaktiivikoguste lisamine tasakaalusüsteemi tasakaalu nihke suunas, milles selle aine kontsentratsioon väheneb ja vastavalt sellele suureneb selle interaktsiooni produktide kontsentratsioon.
Keemilise tasakaalu uurimisel on suur tähtsus nii teoreetilise uurimistöö kui ka praktiliste probleemide lahendamisel. Määrates tasakaaluasendi erinevate temperatuuride ja rõhkude jaoks, on võimalik valida keemilise protsessi jaoks kõige soodsamad tingimused. Protsessi tingimuste lõpliku valiku tegemisel võetakse arvesse ka nende mõju protsessi kiirusele.
Näide 1. Reaktsiooni tasakaalukonstandi arvutamine reagentide tasakaalukontsentratsioonide põhjal.
Arvutage reaktsiooni A + B 2C tasakaalukonstant, kui tasakaalukontsentratsioonid [A] = 0,3 mol∙l -1; [V] = 1,1 mol∙l -1; [C] = 2,1 mol∙l -1.
Lahendus. Selle reaktsiooni tasakaalukonstandi avaldis on kujul: . Asendame siin ülesande püstituses näidatud tasakaalukontsentratsioonid: =5,79.
Näide 2. Reageerivate ainete tasakaalukontsentratsioonide arvutamine. Reaktsioon kulgeb vastavalt võrrandile A + 2B C.
Määrake reageerivate ainete tasakaalukontsentratsioonid, kui ainete A ja B algkontsentratsioonid on vastavalt 0,5 ja 0,7 mol∙l -1 ning reaktsiooni tasakaalukonstant K p = 50.
Lahendus. Iga mooli ainete A ja B kohta tekib 2 mooli ainet C. Kui ainete A ja B kontsentratsiooni vähenemist tähistatakse X mooliga, siis aine kontsentratsiooni suurenemine võrdub 2X mooliga. Reagentide tasakaalukontsentratsioonid on järgmised:
CA = (umbes 5-x)mol∙l-1; CB = (0,7-x) mol∙l-1; C C = 2x mol∙l -1
x 1 = 0,86; x 2 = 0,44
Vastavalt ülesande tingimustele kehtib väärtus x 2. Seega on reagentide tasakaalukontsentratsioonid:
CA = 0,5-0,44 = 0,06 mol∙l -1; C B = 0,7-0,44 = 0,26 mol∙l -1; C C = 0,44∙2 = 0,88 mol∙l -1.
Näide 3. Reaktsiooni Gibbsi energia ∆G o muutuse määramine tasakaalukonstandi K r väärtuse järgi. Arvutage Gibbsi energia ja määrake reaktsiooni võimalikkus CO + Cl 2 = COCl 2 temperatuuril 700 K, kui tasakaalukonstant on võrdne Kp = 1,0685∙10 -4. Kõigi reageerivate ainete osarõhk on sama ja võrdne 101325 Pa-ga.
Lahendus.∆G 700 =2,303∙RT ![]() .
.
Selle protsessi jaoks:
Alates ∆Go<0, то реакция СО+Cl 2 COCl 2 при 700К возможна.
Näide 4. Nihe keemilises tasakaalus. Millises suunas nihkub tasakaal süsteemis N 2 +3H 2 2NH 3 -22kcal:
a) N2 kontsentratsiooni suurenemisega;
b) suureneva H2 kontsentratsiooniga;
c) temperatuuri tõusuga;
d) kui rõhk langeb?
Lahendus. Ainete kontsentratsiooni suurenemine reaktsioonivõrrandi vasakul poolel peaks Le Chatelier’ reegli järgi tekitama protsessi, mis kipub mõju nõrgendama ja viima kontsentratsioonide vähenemiseni, s.t. tasakaal nihkub paremale (juhud a ja b).
Ammoniaagi sünteesi reaktsioon on eksotermiline. Temperatuuri tõus põhjustab tasakaalu nihke vasakule - endotermilise reaktsiooni suunas, nõrgendades mõju (juhtum c).
Rõhu langus (juhtum d) soodustab reaktsiooni, mis viib süsteemi mahu suurenemiseni, st. N 2 ja H 2 moodustumise suunas.
Näide 5. Mitu korda muutub edasi- ja tagurpidi reaktsiooni kiirus süsteemis 2SO 2 (g) + O 2 (g) 2SO 3 (r), kui gaasisegu maht väheneb kolm korda? Millises suunas süsteemi tasakaal nihkub?
Lahendus. Tähistame reagentide kontsentratsioone: = A, =b,=Koos. Massi mõju seaduse kohaselt on edasi- ja tagasisuunaliste reaktsioonide kiirus enne ruumala muutumist võrdsed
v pr = Ka 2 b, v arr = K 1 s 2
Pärast homogeense süsteemi ruumala kolmekordset vähendamist suureneb iga reagendi kontsentratsioon kolm korda: = 3a,[O 2] = 3b; = 3s. Uutel kontsentratsioonidel on edasi- ja tagurpidi reaktsiooni kiirus v" np:
v" np = K(3a) 2 (3b) = 27 Ka 2 b; v o 6 p = K 1 (3c) 2 = 9K 1 c 2.
![]() ;
; ![]()
Järelikult suurenes edasisuunalise reaktsiooni kiirus 27 korda ja vastupidise reaktsiooni kiirus vaid üheksa korda. Süsteemi tasakaal nihkus SO 3 moodustumise suunas.
Näide 6. Arvutage, mitu korda suureneb gaasifaasis toimuva reaktsiooni kiirus, kui temperatuur tõuseb 30 kuni 70 0 C, kui reaktsiooni temperatuuritegur on 2.
Lahendus. Keemilise reaktsiooni kiiruse sõltuvus temperatuurist määratakse empiirilise Van't Hoffi reegliga valemi järgi
Järelikult on reaktsioonikiirus 70 °C juures 16 korda suurem kui reaktsioonikiirus 30 °C juures.
Näide 7. Homogeense süsteemi tasakaalukonstant
CO(g) + H 2 O(g) CO 2 (g) + H 2 (g) 850 °C juures võrdub 1. Arvutage kõigi ainete kontsentratsioonid tasakaalus, kui algkontsentratsioonid on: [CO] ISH = 3 mol/l, [H2O]RI = 2 mol/l.
Lahendus. Tasakaaluseisundis on päri- ja tagasireaktsiooni kiirused võrdsed ning nende kiiruste konstantide suhe on konstantne ja seda nimetatakse antud süsteemi tasakaalukonstandiks:
V np = K 1[CO][H20]; V o b p = TO 2 [CO2][H2];
![]()
Probleemi püstituses on antud algkontsentratsioonid, avaldises aga K r hõlmab ainult kõigi süsteemi ainete tasakaalukontsentratsioone. Oletame, et tasakaaluhetkel on kontsentratsioon [CO 2 ] P = X mol/l. Vastavalt süsteemi võrrandile on ka moodustunud vesiniku moolide arv X mol/l. Sama arvu muttide jaoks (X mol/l) moodustumiseks kulub CO ja H 2 O X mooli CO 2 ja H 2. Seetõttu on kõigi nelja aine tasakaalukontsentratsioonid (mol/l):
[CO2] P = [H2] P = X;[CO] P = (3 – x); P =(2x).
Teades tasakaalukonstanti, leiame väärtuse X, ja seejärel kõigi ainete algkontsentratsioonid:
![]() ; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
; x 2 =6-2x-3x + x 2; 5x = 6, l = 1,2 mol/l.
Keemiline tasakaal on pöörduva keemilise reaktsiooni seisund.
aA+ b B= c C+ d D,
mille puhul reaktsioonisegus reaktiivide kontsentratsioonid aja jooksul ei muutu. Iseloomustatakse keemilise tasakaalu seisundit keemilise tasakaalu konstant:
Kus C i- komponentide kontsentratsioon tasakaal ideaalne segu.
Tasakaalukostandit saab väljendada ka tasakaalu moolifraktsioonides X i komponendid:
Gaasifaasis toimuvate reaktsioonide puhul on mugav väljendada tasakaalukonstanti tasakaaluliste osarõhkude kaudu P i komponendid:
Ideaalsete gaaside jaoks P i = C i RT Ja P i = X ja P, Kus P on seega kogurõhk K P, K C Ja K X on seotud järgmise suhtega:
K P = K C (RT) c+d–a–b = K X P c+d–a–b. (9.4)
Tasakaalukonstant on seotud rG o keemiline reaktsioon:
![]() (9.5)
(9.5)
![]() (9.6)
(9.6)
Muuda rG või r F keemilises reaktsioonis etteantud (mitte tingimata tasakaalulistel) osarõhkudel P i või kontsentratsioonid C i komponente saab arvutada võrrandi abil keemilise reaktsiooni isotermid (van't Hoffi isotermid):
 . (9.7)
. (9.7)
 . (9.8)
. (9.8)
Vastavalt Le Chatelier’ põhimõte, kui tasakaalus olevale süsteemile avaldatakse väline mõju, siis tasakaal nihkub nii, et välismõju mõju väheneb. Seega nihutab rõhu tõus tasakaalu gaasimolekulide arvu vähenemise suunas. Mis tahes reaktsioonikomponendi lisamine tasakaalusegusse nihutab tasakaalu selle komponendi koguse vähenemise suunas. Temperatuuri tõus (või langus) nihutab tasakaalu reaktsiooni suunas, mis toimub soojuse neeldumisel (eraldumisel).
Tasakaalukonstandi kvantitatiivset sõltuvust temperatuurist kirjeldab võrrand keemilise reaktsiooni isobaarid (van't Hoffi isobaarid)
![]() (9.9)
(9.9)
Ja keemilise reaktsiooni isohoorid (van't Hoffi isohoorid)
![]() . (9.10)
. (9.10)
Võrrandi (9.9) integreerimine eeldusel, et r H reaktsioon ei sõltu temperatuurist (mis kehtib kitsastes temperatuurivahemikes), annab:
![]() (9.11)
(9.11)
![]() (9.12)
(9.12)
Kus C – integratsioonikonstant. Seega on sõltuvus ln K P alates 1 /T peab olema lineaarne ja sirge kalle on – r H/R.
Integratsioon sees K 1 , K 2 ja T 1, T 2 annab:
 (9.13)
(9.13)
 (9.14)
(9.14)
Seda võrrandit kasutades, teades tasakaalukonstante kahel erineval temperatuuril, saame arvutada r H reaktsioonid. Vastavalt sellele, teades r H reaktsiooni ja tasakaalukonstanti ühel temperatuuril, saate arvutada tasakaalukonstandi teisel temperatuuril.
NÄITED
CO(g) + 2H2 (g) = CH3OH(g)
500 K juures. f G o CO(g) ja CH3OH(g) jaoks on 500 K juures –155,41 kJ. mol –1 ja –134,20 kJ. mol –1 vastavalt.
Lahendus. G o reaktsioonid:
r G o= f G o(CH3OH) – f G o(CO) = –134,20 – (–155,41) = 21,21 kJ. mol –1.
![]() = 6.09 10 –3 .
= 6.09 10 –3 .
Näide 9-2. Reaktsiooni tasakaalu konstant
võrdne K P = 1,64 10 –4 temperatuuril 400 o C. Millist kogurõhku tuleb avaldada ekvimolaarsele N 2 ja H 2 segule, et 10% N 2 muutuks NH 3 -ks? Gaase peetakse ideaalseks.
Lahendus. Laske N 2 moolil reageerida. Siis
| N 2 (g) | + | 3H 2 (g) | = | 2NH3 (g) | |
| Algne kogus | 1 | 1 | |||
| Tasakaalu kogus | 1– | 1–3 | 2 (kokku: 2–2) | ||
| Tasakaalu moolifraktsioon: |
Seega K X =  Ja K P = K X . P –2
=
Ja K P = K X . P –2
=  .
.
Asendades saadud valemis = 0,1, saame
1.64 10 –4 =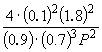 , kus P= 51,2 atm.
, kus P= 51,2 atm.
Näide 9-3. Reaktsiooni tasakaalu konstant
CO(g) + 2H2 (g) = CH3OH(g)
500 K juures on võrdne K P = 6,09 10 –3 . Reaktsioonisegu, mis sisaldab 1 mol CO, 2 mol H 2 ja 1 mol inertgaasi (N 2), kuumutatakse temperatuurini 500 K ja kogurõhuni 100 atm. Arvutage tasakaalusegu koostis.
Lahendus. Laske CO moolil reageerida. Siis
| CO(g) | + | 2H 2 (g) | = | CH3OH (g) | |
| Algne kogus: | 1 | 2 | 0 | ||
| Tasakaalu kogus: | 1– | 2–2 | |||
| Kokku tasakaalusegus: | 3-2 mol komponente + 1 mol N 2 = 4-2 mol | ||||
| Tasakaalu moolifraktsioon | |||||
Seega K X =  Ja K P = K X . P–2 =
Ja K P = K X . P–2 = ![]() .
.
Seega 6,09 10 –3 = ![]() .
.
Selle võrrandi lahendamisel saame = 0,732. Vastavalt sellele on ainete mooliosad tasakaalusegus võrdsed: = 0,288, = 0,106, = 0,212 ja = 0,394.
Näide 9-4. Reaktsiooni jaoks
N2 (g) + 3H2 (g) = 2NH3 (g)
298 K juures K P = 6,0 10 5, a f H o(NH3) = –46,1 kJ. mol –1. Hinnake tasakaalukonstandi väärtust temperatuuril 500 K.
Lahendus. Reaktsiooni standardne molaarne entalpia on
r H o= 2f H o(NH3) = –92,2 kJ. mol –1.
Vastavalt võrrandile (9.14)  =
=
Ln (6,0 10 5) + ![]() = –1,73, kust K 2 =
0.18.
= –1,73, kust K 2 =
0.18.
Pange tähele, et eksotermilise reaktsiooni tasakaalukonstant väheneb temperatuuri tõustes, mis vastab Le Chatelier' põhimõttele.
ÜLESANDED
- 1273 K juures ja kogurõhul 30 atm tasakaalulises segus
- Temperatuuril 2000 o C ja kogurõhul 1 atm dissotsieerub 2% veest vesinikuks ja hapnikuks. Arvutage reaktsiooni tasakaalukonstant
- Reaktsiooni tasakaalu konstant
- Reaktsiooni tasakaalu konstant
- 3-liitrine anum, mis sisaldas 1,79 10–2 mol I 2, kuumutati temperatuurini 973 K. Rõhk anumas tasakaaluolekus osutus 0,49 atm. Eeldades, et gaasid on ideaalsed, arvutage reaktsiooni tasakaalukonstant temperatuuril 973 K
- Reaktsiooni jaoks
- Reaktsiooni jaoks
- 1-liitrine anum, mis sisaldas 0,341 mol PCl 5 ja 0,233 mol N 2, kuumutati temperatuurini 250 o C. Kogurõhk anumas tasakaaluolekus osutus 29,33 atm. Eeldades, et kõik gaasid on ideaalsed, arvutage anumas toimuva reaktsiooni tasakaalukonstant temperatuuril 250 o C
- Reaktsiooni tasakaalu konstant
- 25 o C juures f G o(NH 3) = –16,5 kJ. mol –1. Arvutama rG NH3 moodustumise reaktsioonid N2, H2 ja NH3 osarõhkudel vastavalt 3 atm, 1 atm ja 4 atm. Millises suunas toimub reaktsioon nendes tingimustes spontaanselt?
- Eksotermiline reaktsioon
- Borneooli (C 10 H 17 OH) isomerisatsiooni isoborneooliks gaasifaasilise reaktsiooni tasakaalukonstant on 503 K juures 0,106. 7,5 g borneooli ja 14,0 g isoborneooli segu pandi 5-liitrisesse anumasse ja hoiti. temperatuuril 503 K kuni tasakaalu saavutamiseni. Arvutage borneooli ja isoborneooli mooliosad ja massid tasakaalusegus.
- Tasakaal reaktsioonis
- Arvutage kogurõhk, mis tuleb rakendada segule, mis koosneb 3 osast H 2 ja 1 osast N 2, et saada tasakaaluline segu, mis sisaldab 10 mahuprotsenti NH 3 400 o C juures. Reaktsiooni tasakaalukonstant
- Temperatuuril 250 o C ja üldrõhul 1 atm dissotsieerub PCl 5 reaktsiooni käigus 80%
- 2000 o C juures reaktsiooniks
- Arvutage reaktsiooni standardentalpia, mille tasakaalukonstant on
a) tõuseb 2 korda, b) väheneb 2 korda, kui temperatuur muutub 298 K-lt 308 K-ni. - Reaktsiooni 2C 3 H 6 (g) = C 2 H 4 (g) + C 4 H 8 (g) tasakaalukonstandi sõltuvust temperatuurist vahemikus 300 K kuni 600 K kirjeldab võrrand
CO 2 (g) + C (tv) = 2CO (g)
sisaldab 17% (mahu järgi) CO 2 . Kui suur protsent CO 2 sisaldub gaasis kogurõhul 20 atm? Millise rõhu juures sisaldab gaas 25% CO 2?
H20 (g) = H2 (g) + 1/2O2 (g) nendes tingimustes.
CO (g) + H 2 O (g) = CO 2 (g) + H 2 (g)
500 o C juures on võrdne K p= 5,5. Segu, mis sisaldas 1 mol CO ja 5 mol H20, kuumutati selle temperatuurini. Arvutage H 2 O mooliosa tasakaalusegus.
N 2 O 4 (g) = 2NO 2 (g)
25 o C juures on võrdne K p= 0,143. Arvutage rõhk, mis tekib 1-liitrises anumas, millesse pandi sellel temperatuuril 1 g N 2 O 4.
I2 (g) = 2I (g).
250 o C juures rG o = –2508 J mol –1. Millise üldrõhu juures on PCl 5 muutumise määr PCl 3-ks ja Cl 2 -ks 250 o C juures 30%?
2HI (g) = H2 (g) + I 2 (g)
tasakaalukonstant K P = 1,83 10 –2 temperatuuril 698,6 K. Mitu grammi HI tekib, kui kolmeliitrises anumas kuumutatakse selle temperatuurini 10 g I 2 ja 0,2 g H 2? Millised on H 2, I 2 ja HI osarõhud?
PCl5 (g) = PCl3 (g) + Cl2 (g)
CO(g) + 2H2 (g) = CH3OH(g)
500 K juures on võrdne K P = 6,09 10 –3 . Arvutage kogurõhk, mis on vajalik metanooli tootmiseks 90% saagisega, kui CO ja H2 on suhtega 1:2.
CO(g) + 2H2 (g) = CH3OH(g)
on tasakaalus 500 K ja 10 baari juures. Kui gaasid on ideaalsed, siis kuidas mõjutavad metanooli saagist järgmised tegurid: a) suurenevad T; b) edutamine P; c) inertgaasi lisamine temperatuuril V= const; d) inertgaasi lisamine temperatuuril P= const; e) H2 lisamine at P= konst?
2NOCl(g) = 2NO(g) + Cl2 (g)
seatud temperatuurile 227 o C ja kogurõhule 1,0 baari, kui NOCl osarõhk on 0,64 baari (esialgu oli ainult NOCl). Arvutama r G o reaktsiooni jaoks. Millise kogurõhu korral on Cl 2 osarõhk 0,10 baari?
N2 (g) + 3H2 (g) = 2NH3 (g)
400 o C juures on võrdne K = 1.60 10 –4 .
PCl5 (g) = PCl3 (g) + Cl2 (g).
Kui suur on PCl 5 dissotsiatsiooniaste, kui süsteemi lisada N 2 nii, et lämmastiku osarõhk on 0,9 atm? Kogurõhku hoitakse 1 atm.
N 2 (g) + O 2 (g) = 2NO (g)
K p = 2,5 10 –3 . N 2, O 2, NO ja inertgaasi tasakaaluline segu kogurõhul 1 bar sisaldab 80% (mahu järgi) N 2 ja 16% O 2 . Mitu mahuprotsenti on EI? Mis on inertgaasi osarõhk?
ln K = –1.04 –1088 /T +1.51 10 5 /T 2 .
Keemiline tasakaal- süsteemi olek, mil otse- ja pöördreaktsioonil on sama kiirus.. Lähteainete vähenemisega protsessi käigus otsese kemikaali kiirus. reaktsioon väheneb ja pöördreaktsiooni kiirus suureneb CHI suurenemisega. Mingil ajahetkel edasi- ja tagurpidi keemia kiirus. reaktsioonid on võrdsed Süsteemi olek ei muutu enne, kui mõjuvad välistegurid (P, T, c) Kvantitatiivselt iseloomustatakse tasakaaluseisundit tasakaalukonstandi abil. Tasakaalukonstant – konstant , peegeldades pöörduva reaktsiooni komponentide kontsentratsioonide suhet keemilises tasakaalus. (sõltub ainult C-st.) Iga puhul pöörame keemia ümber. reaktsioonid konkreetsetes tingimustes näivad iseloomustavat piiri, milleni kemikaal läheb. reaktsioon. .K=.Kui (kontsentratsioon ref) - reaktsiooni ei toimu; kui tasakaal nihkub paremale - ei toimu. Tasakaalukonstant ei muuda oma väärtust reagentide kontsentratsiooni muutumisel. Fakt on see, et kontsentratsiooni muutus toob kaasa ainult keemilise koostise muutumise. tasakaalu ühes või teises suunas. Sel juhul luuakse sama konstandi juures uus tasakaaluseisund . Tõeline tasakaal võib nihutada ühele või teisele poole mis tahes tegurite mõjul. Kuid kui need tegurid tühistatakse, naaseb süsteem algsesse olekusse. Vale- süsteemi olek on ajas muutumatu, kuid välistingimuste muutumisel toimub süsteemis pöördumatu protsess (Pimedal on olemas H 2 + Cl 2, valgustades tekib HCl. Valgustuse katkemisel H 2 ja Cl 2 ei naase). Vähemalt ühe neist teguritest muutumine viib tasakaalunihkeni. Erinevate tegurite mõju keemilise võrrandi olekule kirjeldab kvalitatiivselt tasakaalu nihutamise põhimõte, mille autor on Le Chatelier (1884: mis tahes välise mõjuga süsteemile, mis on keemilises tasakaalus, toimuvad selles protsessid, mis viivad selle mõju vähenemiseni.
Tasakaalukonstant
Tasakaalukonstant näitab Mitu korda on edasisuunalise reaktsiooni kiirus suurem või väiksem kui pöördreaktsiooni kiirus?
Tasakaalukonstant on reaktsioonisaaduste tasakaalukontsentratsioonide korrutis nende stöhhiomeetriliste koefitsientide astmes ja lähteainete tasakaalukontsentratsioonide korrutis nende stöhhiomeetriliste koefitsientide astmes.
Tasakaalukonstandi väärtus sõltub reagentide olemusest ja temperatuurist ning ei sõltu kontsentratsioonist tasakaaluhetkel, kuna nende suhe on alati konstantne väärtus, arvuliselt võrdne tasakaalukonstandiga. Kui lahuses olevate ainete vahel toimub homogeenne reaktsioon, märgitakse tasakaalukonstantiks K C ja kui gaaside vahel, siis K R.
kus Р С, Р D, Р А ja Р В on reaktsioonis osalejate tasakaalurõhud.
Kasutades Clapeyron-Mendelejevi võrrandit, on võimalik määrata seos K P ja K C vahel
Liigutame helitugevust paremale poole
p = RT, st p = CRT (6,9)
Asendame võrrandi (6.9) võrrandiga (6.7) iga reagendi puhul ja lihtsustame
![]()
![]() ,
(6.10)
,
(6.10)
kus Dn on gaasilise reaktsiooni osalejate moolide arvu muutus
Dn = (c + d) – (a + c) (6.11)
Seega
K P = K C (RT) Dn (6,12)
Võrrandist (6.12) selgub, et K P = K C, kui reaktsioonis gaasiliste osalejate moolide arv ei muutu (Dn = 0) või süsteemis gaase ei esine.
Tuleb märkida, et heterogeense protsessi korral ei võeta arvesse tahke või vedela faasi kontsentratsiooni süsteemis.
Näiteks vormiga 2A + 3B = C + 4D reaktsiooni tasakaalukonstant, eeldusel, et kõik ained on gaasid ja nende vorm
ja kui D on tahke, siis
Tasakaalukonstandil on suur teoreetiline ja praktiline tähtsus. Tasakaalukostandi arvväärtus võimaldab hinnata keemilise reaktsiooni praktilist võimalikkust ja sügavust.
10 4, siis on reaktsioon pöördumatu
Tasakaalu nihe. Le Chatelier’ põhimõte.
Le Chatelier’ põhimõte (1884): kui stabiilses keemilises tasakaalus olevat süsteemi mõjutab väljastpoolt muutuv temperatuur, rõhk või kontsentratsioon, siis keemiline tasakaal nihkub suunas, milles mõju mõju väheneb.
Tuleb märkida, et katalüsaator ei nihuta keemilist tasakaalu, vaid ainult kiirendab selle algust.
Vaatleme iga teguri mõju üldise reaktsiooni keemilise tasakaalu nihkele:
aA + bB = cC + d D±Q.
Kontsentratsiooni muutuste mõju. Le Chatelier' põhimõtte kohaselt viib tasakaalulise keemilise reaktsiooni ühe komponendi kontsentratsiooni suurenemine tasakaalu nihkumiseni selle reaktsiooni intensiivistumise suunas, milles toimub selle komponendi keemiline töötlemine. Ja vastupidi, ühe komponendi kontsentratsiooni vähenemine viib tasakaalu nihkeni selle komponendi moodustumise suunas.
Seega nihutab aine A või B kontsentratsiooni suurenemine tasakaalu edasisuunas; aine C või D kontsentratsiooni suurenemine nihutab tasakaalu vastupidises suunas; A või B kontsentratsiooni vähenemine nihutab tasakaalu vastupidises suunas; aine C või D kontsentratsiooni vähenemine nihutab tasakaalu edasisuunas. (Skeemiliselt võite kirjutada: C A või C B ®; C C või C D ¬; ¯ C A või C B ¬; ¯ C C või C D ®).
Temperatuuri mõju.Üldreegel, mis määrab temperatuuri mõju tasakaalule, on järgmise sõnastusega: temperatuuri tõus soodustab tasakaalu nihkumist endotermilise reaktsiooni suunas (-Q); temperatuuri langus soodustab tasakaalu nihkumist eksotermilise reaktsiooni suunas (+ Q).
Reaktsioonid, mis toimuvad ilma termiliste mõjudeta, ei muuda temperatuuri muutumisel keemilist tasakaalu. Temperatuuri tõus toob sel juhul kaasa vaid kiirema tasakaalu saavutamise, mis oleks antud süsteemis saavutatud ilma kütteta, kuid pikema aja jooksul.
Seega põhjustab eksotermilise reaktsiooni (+ Q) temperatuuri tõus tasakaalu nihkumist vastupidises suunas ja vastupidi, endotermilises reaktsioonis (- Q) põhjustab temperatuuri tõus temperatuuri nihke. edasisuunas ja temperatuuri langus vastupidises suunas. (Skeemiliselt võime kirjutada: +Q Т ¬; ¯Т ®; -Q Т ®; ¯Т ¬).
Surve mõju. Nagu kogemus näitab, mõjutab rõhk märgatavalt ainult nende tasakaalureaktsioonide nihkumist, milles osalevad gaasilised ained, ja samal ajal ei ole gaasilise reaktsiooni osalejate moolide arvu muutus (Dn) võrdne nulliga. Rõhu tõustes nihkub tasakaal reaktsiooni suunas, millega kaasneb vähem gaasiliste ainete moolide moodustumist, ja rõhu vähenedes suurema hulga gaasiliste ainete moolide tekke suunas.
Seega, kui Dn = 0, siis rõhk ei mõjuta keemilise tasakaalu nihet; kui Dn< 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если Dn >0, siis rõhu tõus nihutab tasakaalu vastupidises suunas ja rõhu langus nihutab seda edasisuunalise reaktsiooni suunas. (Skemaatiliselt võime kirjutada: Dn = 0 korral P ei mõjuta; Dn juures<0 Р®, ¯Р¬; при Dn >0 Р ¬, ¯Р ®). Le Chatelier' põhimõte on rakendatav nii homogeensete kui ka heterogeensete süsteemide puhul ja annab tasakaalunihke kvalitatiivse tunnuse.
Pöörduvate protsesside keemilise tasakaalu seisundit iseloomustab kvantitatiivselt tasakaalukonstant. Näiteks pööratava reaktsiooni (7.3) korral kirjutatakse massimõju seaduse järgi (vt § 6.1) edasisuunalise reaktsiooni kiirused v( ja vastupidine v2 vastavalt järgmiselt: Keemilise tasakaalu seisundis on päri- ja pöördreaktsiooni kiirused võrdsed, st kus Kg - tasakaalukonstant, mis on päri- ja pöördreaktsiooni kiiruskonstantide suhe. võrrandi (7.4) paremal küljel on need interakteeruvad ained, mis tekivad tasakaalu saavutamisel - tasakaalukontsentratsioonid (tavaliselt molaarsed kontsentratsioonid) Võrrandi (7.4) vasak pool kujutab konstantset (konstantsel temperatuuril) suurust. Saab näidata, et pöörduva keemilise reaktsiooni puhul on kirjutatud üldkujul , Keemilise tasakaalu konstant, tasakaalukonstant väljendatakse võrrandiga [AG(B]R) Võrrand (7.6) on keemilise tasakaalu massimõju seaduse matemaatiline väljend See seadus on keemias üks olulisemaid. mis tahes keemilise reaktsiooni kineetilisele võrrandile saame kohe kirjutada reagentide ja reaktsioonisaaduste tasakaalukontsentratsioone ühendava seose kujul (7.6). Kui konstant Kc määratakse katseliselt, mõõtes kõikide ainete tasakaalukontsentratsioone antud temperatuuril, siis saab saadud väärtust kasutada arvutustes teistel samal temperatuuril tasakaalujuhtumitel. Eriti tuleb märkida, et erinevalt reaktsioonikiiruse massimõju seadusest (vt § 6.1) on antud juhul võrrandis (7.6) eksponendid p, d, n jne alati võrdsed stöhhiomeetriliste koefitsientidega. tasakaalureaktsioonis ( 7.5). Gaase sisaldavate reaktsioonide puhul väljendatakse tasakaalukonstanti osarõhkudes, mitte nende kontsentratsioonides. Sel juhul tähistatakse tasakaalukonstanti sümboliga Kg Tasakaalukostandi arvväärtus iseloomustab reaktsiooni toimumise tendentsi ehk teisisõnu määrab selle saagise. Reaktsiooni saagis on tegelikult saadud produkti koguse suhe kogusesse, mis oleks saadud reaktsiooni lõppedes (tavaliselt väljendatakse protsentides). Seega, kui Ku*> 1, on reaktsiooni (7.5) saagis kõrge, kuna sel juhul on V palju suurem kui hõbeioonide kontsentratsiooni ruut. Vastupidiselt näitab madal K väärtus näiteks reaktsioonis AgI(T)^Ag++r, et tasakaalu saavutamise ajaks oli tühine kogus hõbejodiidi Agl lahustunud. Tõepoolest, Agl-i lahustuvus vees on äärmiselt madal. Pöörame tähelepanu tasakaalukonstantide avaldise kirjutamise vormile (vt tabeli 7.1 veerg 2). Kui mõne reaktiivi kontsentratsioon reaktsiooni käigus oluliselt ei muutu, siis neid ei kaasata tasakaalukonstandi avaldisesse, vaid need sisalduvad tasakaalukonstandi enda sees (tabelis 7.1 on sellised konstandid tähistatud K1-ga). Näiteks reaktsiooni (7.7) jaoks avaldise Keemilise tasakaalu konstant asemel tabelis. 7L leiame avaldise See on seletatav asjaoluga, et metallilise vase ja metallilise hõbeda kontsentratsioonid sisestatakse tasakaalukonstandisse. Vase metalli kontsentratsioon määratakse selle tiheduse järgi ja seda ei saa muuta. Sama võib öelda ka metallilise hõbeda kontsentratsiooni kohta. Kuna ükski neist kontsentratsioonidest ei sõltu võetud metalli kogusest, ei ole vaja neid tasakaalukonstandi arvutamisel arvesse võtta. AgCl ja Agl lahustumise tasakaalukonstantide avaldisi selgitatakse sarnaselt. Vee dissotsiatsioonireaktsiooni tasakaalukonstandi kohta (K1-= 10"14 temperatuuril 25 aC) vt täpsemalt § 9.2.